- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему: Окислительно - восстановительные реакции в заданиях ОГЭ по химии
Содержание
- 2. «Никакая деятельность не может быть прочна, если
- 3. ОВР – это реакция, идущая с изменением степени окисления элементов.Окислительно- восстановительные реакции
- 4. Многие реакции в природе являются окислительно- восстановительными, например фотосинтез, дыхание, горение и др.
- 5. Примеры окислительно – восстановительных реакций
- 6. Примеры окислительно – восстановительных реакций
- 7. Примеры окислительно – восстановительных реакций
- 8. Примеры окислительно – восстановительных реакций
- 9. условная величина, показывающая заряд атома в молекуле.Степень окисления
- 10. Степень окисленияСтепень окисления никогда не показывает реальный
- 11. Окислитель - это атом или ион в молекуле, который забирает электроны
- 12. Восстановитель – это атом или ион в молекуле, который отдает электроны
- 13. Окислитель в ходе реакции восстанавливается, а восстановитель - окисляется
- 14. ВеществоВосстановительОтдача электроновПроцесс окисления
- 15. ВеществоОкислительПринятие электроновПроцесс восстановления
- 16. Для запоминания можно использовать следующий приемООВВВО
- 17. ОтдалОкислилсяВосстановительООВ
- 18. ВзялОкислилсяВосстановилсяОкислительВВО
- 19. активные неметаллы – фтор, хлор, кислородОкислителисоли: KСlO4,
- 20. Восстановителиметаллывещества с минимально возможной (отрицательной) степенью окисления неметалла KI, NaBr, K2Sводородные соединения: NН3, HI, HBr, H2S
- 21. Чтобы определить степень окисления атома в молекуле,
- 22. Сущность окислительно-восстановительной реакции (ОВР)Изменение степени окисления элементов и переход электронов от восстановителя к окислителю
- 23. Составление окислительно-восстановительной реакции (ОВР)Основное правило, которым мы
- 24. Первый вариант заданияСера является окислителем в реакции:H2S
- 25. Распишем первое уравнение:H2S + I2 = S
- 26. Перейдем ко второй реакции: 3S + 2Al
- 27. Третья реакция:2SO2 + О2 = 2SO3Исходные вещества:степень
- 28. Последняя реакция:S + 3NO2 = SO3 +
- 29. В 20 задании ОГЭ по химии необходимо
- 30. Теперь рассмотрим метод электронного баланса на типовом
- 31. Метод электронного балансаМетод электронного баланса - метод
- 32. Алгоритм наших действий выглядит следующим образом:Вычисляем изменение степени
- 33. Используя метод электронного баланса, расставьте коэффициенты в
- 34. Итак, составляем электронный баланс. В данной реакции
- 35. HI–1 + H2S+6O4 → I20 + H2S
- 36. При подготовке к выполнению заданиянеобходимообратить внимание на:
- 37. А на экзамене…«Сможешь. Ибо ты обрел знание»
- 38. Скачать презентацию
- 39. Похожие презентации
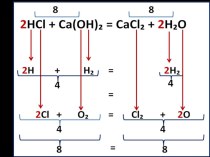
«Никакая деятельность не может быть прочна, если она не имеет основы в личном интересе» Л.Н. ТолстойHI + H2SO4 → I2 + H2S + H2O






































Слайд 2 «Никакая деятельность не может быть прочна, если она
не имеет основы в личном интересе» Л.Н. Толстой
H2SO4 → I2 + H2S + H2OСлайд 3 ОВР – это реакция, идущая с изменением степени
окисления элементов.
Окислительно- восстановительные реакции
Слайд 4 Многие реакции в природе являются окислительно- восстановительными, например
фотосинтез, дыхание, горение и др.
Слайд 10
Степень окисления
Степень окисления никогда не показывает реальный заряд
атома - это условная величина, принимаемая нами для удобства
расчётов химических реакций.
Слайд 19
активные неметаллы – фтор, хлор, кислород
Окислители
соли: KСlO4, KClO3,
KNO3, KMnO4, K2Cr2O7
кислоты: HNO3, H2SO4, HClO4, H2Cr2O7
оксиды: PbO2, Mn2O7,
CrO3, N2O5
Слайд 20
Восстановители
металлы
вещества с минимально возможной (отрицательной) степенью окисления
неметалла KI, NaBr,
K2S
водородные соединения: NН3, HI, HBr, H2S
Слайд 21 Чтобы определить степень окисления атома в молекуле, следует
пользоваться следующими правилами:
степень окисления водорода всегда +1
исключение гидриды
металловстепень окисления кислорода всегда -2
(исключения - пероксиды и фториды)
степень окисления металлов первой группы +1, второй +2, алюминия +3
Слайд 22
Сущность окислительно-восстановительной реакции (ОВР)
Изменение степени окисления элементов и
переход электронов от восстановителя к окислителю
Слайд 23
Составление окислительно-восстановительной реакции (ОВР)
Основное правило, которым мы должны
руководствоваться при составлении ОВР:
Количество электронов, отданное восстановителем, равно количеству
электронов, принятых окислителем.Именно этот факт позволяет уравнять химическую реакцию.
Слайд 24
Первый вариант задания
Сера является окислителем в реакции:
H2S +
I2 = S + 2HI
3S + 2Al = Al2S3
2SO2
+ О2 = 2SO3S + 3NO2 = SO3 + 3NO
Слайд 25
Распишем первое уравнение:
H2S + I2 = S +
2HI
Исходные вещества:
степень окисления серы в молекуле сероводорода равен -2,
так как водород всегда +1степень окисления йода 0, так как это простое вещество
Продукты реакции:
степень окисления серы 0, простое вещество
степень окисления йода -1, так как водород +1
Анализируем:
сера поменяла степень окисления с -2 до 0, значит отдала электроны - она восстановитель (но сама сера окислилась!)
йод поменял степень окисления с 0 до -1, значит он принял электроны - окислитель (но сам по себе йод восстановился!)
Слайд 26 Перейдем ко второй реакции: 3S + 2Al = Al2S3 Исходные
вещества: степень окисления серы 0, простое вещество степень окисления алюминия 0, так
как это тоже простое вещество Поскольку реагирует металл и неметалл, то можно сразу понять, что металл восстановитель, а неметалл - окислитель и это верный ответ, но мы продолжим разбор Продукты реакции: степень окисления алюминия +3 степень окисления серы -2 Анализируем: сера из нулевой степени окисления стала -2, значит забрала электроны и восстановилась, но сама сера - окислитель алюминий отдал электроны и окислился - он восстановитель
Слайд 27
Третья реакция:
2SO2 + О2 = 2SO3
Исходные вещества:
степень окисления
серы +4, так как у кислорода заряд -2, и их
два атомастепень окисления кислорода 0, так как это простое вещество
Поскольку реагирует кислород и образуется оксид, можно догадаться, что сера здесь выступает восстановителем и окисляется, докажем это:
Продукты реакции:
степень окисления серы +6
степень окисления кислорода -2
Анализируем:
сера отдала последние два электрона и окислилась, являясь восстановителем
кислород забрал электроны и восстановился, являясь окислителем
Слайд 28
Последняя реакция:
S + 3NO2 = SO3 + 3NO
Исходные
вещества:
степень окисления серы 0, так как это простое вещество
степень окисления азота +4, так
как у кислорода -2, и их два атомаПродукты реакции:
степень окисления серы +6, так как у кислорода степень окисления -2, и их три атома в молекуле
степень окисления азота +2, так как у кислорода -2
Анализируем:
сера отдала 6 электронов и окислилась, являясь восстановителем
азот забрал электроны и восстановился, являясь окислителем
Ответ: 2
Слайд 29 В 20 задании ОГЭ по химии необходимо полностью
предоставить решение. Решение 20 задания - составление уравнения химической
реакции методом электронного баланса.Слайд 30 Теперь рассмотрим метод электронного баланса на типовом примере,
но перед этим вспомним, что это за метод и
как им пользоваться.
Слайд 31
Метод электронного баланса
Метод электронного баланса - метод уравнивания
химических реакций, основанный на изменении степеней окисления атомов в
химических соединениях.
Слайд 32
Алгоритм наших действий выглядит следующим образом:
Вычисляем изменение степени окисления
каждого элемента в уравнении химической реакции
Выбираем только те элементы,
которые поменяли степень окисленияДля найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
Находим наименьшее общее кратное для переданных электронов
Полученные значения и есть коэффициенты в уравнении (за редким исключением)
Определить окислитель и восстановитель
Слайд 33 Используя метод электронного баланса, расставьте коэффициенты в уравнении
реакции, схема которой
HI + H2SO4 → I2 + H2S
+ H2OОпределите окислитель и восстановитель.
Слайд 34 Итак, составляем электронный баланс. В данной реакции меняют
степени окисления сера и йод.
Сера находилась в степени окисления +6, а в
продуктах -2. Йод имел степень окисления -1, а стал 0.
Если у Вас возникли трудности с расчетом, то вспомните, как рассчитывать степень окисления.
Слайд 35 HI–1 + H2S+6O4 → I20 + H2S –2+
H2O
1 | S+6 + 8ē → S –2
4 | 2I–1 –
2ē → I20 Сера приняла 8 электронов, а йод отдал только два.
Наименьшее общее кратное 8, дополнительные множители 1 и 4
Расставляем коэффициенты в уравнении реакции согласно полученным данным:
8HI + H2SO4 = 4I2 + H2S + 4H2O
Не забываем указать, что сера в степени окисления +6 является окислителем, а иод в степени окисления –1 – восстановителем.
Слайд 36
При подготовке к выполнению задания
необходимо
обратить внимание на:
тщательный
анализ условия задания
выяснение сущности описанных превращений
получение максимальной информации из
условия;проверку соответствия решения условию.