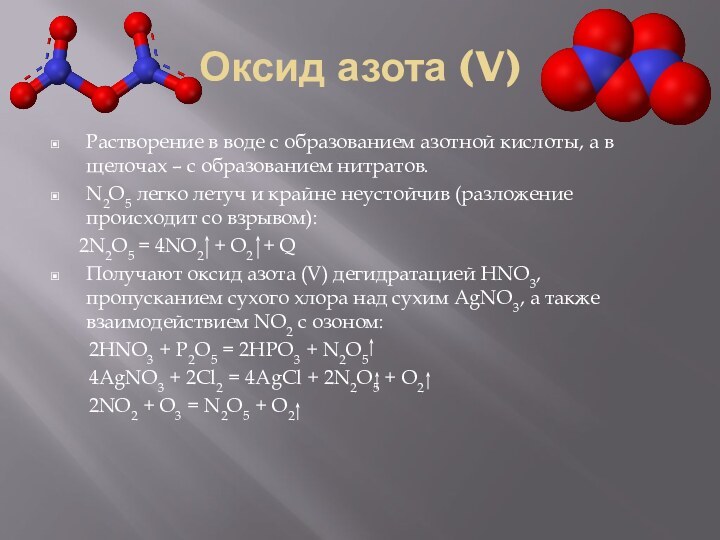
(I) – «веселящий газ», так как в малых дозах
вызывает конвульсивный смех, в медицине используется для ингаляционного наркоза.Получают при термическом разложении нитрата аммония при 250оC и при взаимодействии некоторых металлов с азотной кислотой.
NH4NO3 N2O + 2H2O
Он химически инертен при нормальных условиях, но при нагревании обладает окислительными свойствами и может поддерживать горение, например, серы, углерода, фосфора:
P4 + 10N2O = P4O10 + 10N2.
Может проявлять свойства восстановителя при взаимодействии с сильными окислителями:
5N2O+8RMnO4+7H2SO4=5Mn(NO3)2+3MnSO4+4K2SO4+7H2O
При нагревании N2O разлагается на N2 и O2.
Более удобным способом получения является:
NH2SO2OH(сульфаминовая к-та) + HNO3(73%) to= N2O + SO2(OH)2 + H2O