ядер характеризуется электронной плотностью (зарядом) на атоме, а химическая
связь – порядком связи. Кроме этих величин иногда используют так называемую свободную валентность как критерий реакционной способности эффективных атомов.
Где K – число ядер в молекуле, Mα - число АО, центрированных на ядре α, и верхний индекс в обозначениях коэффициентов МО введен, чтобы подчеркнуть принадлежность k-ой АО к α – ому ядру. Суммы Pαα называют электронной плотностью на α – ом атоме. Если учесть, что атом α имеет ядро с зарядом Zα, то полный эффективный заряд атома будет qα = Zα − P αα . Р. Малликен
Для характеристики электронной плотности в пространстве между ядрами α и β Ч. Коулсон предложил использовать так называемый порядок связи, или:
Заряд
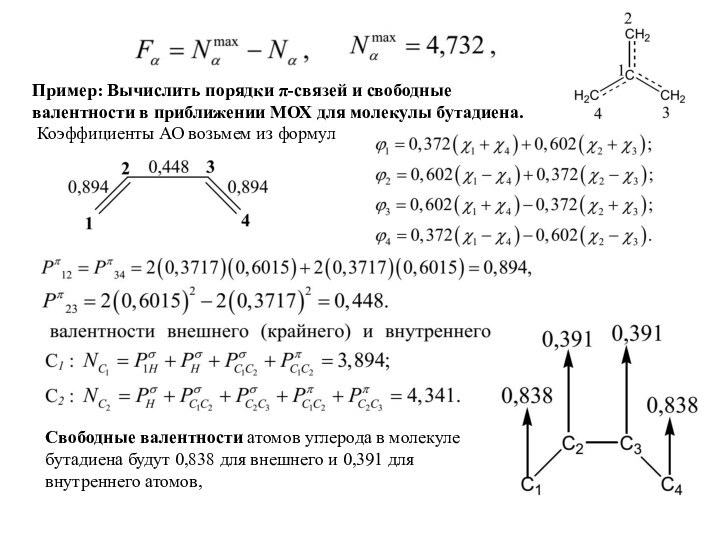
В приближении МОХ на основании порядков связей можно определить валентность атома. Эта
величина для атома α в молекуле оценивается путем суммирования порядков связей этого атома:
Индекс свободной валентности: