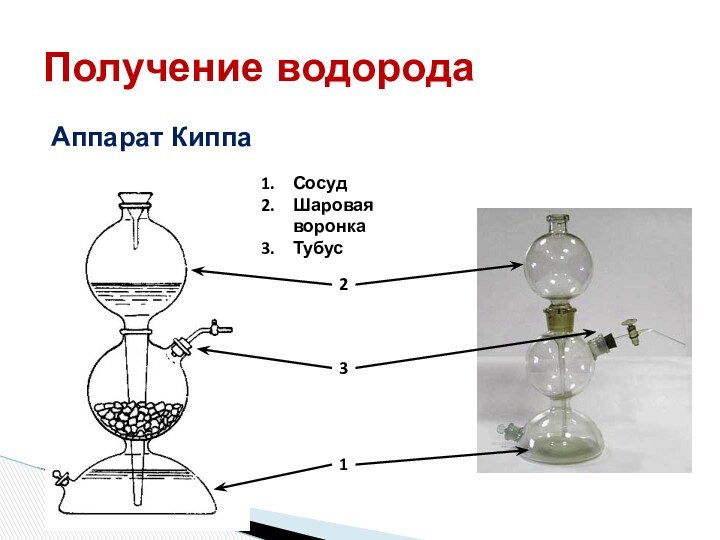
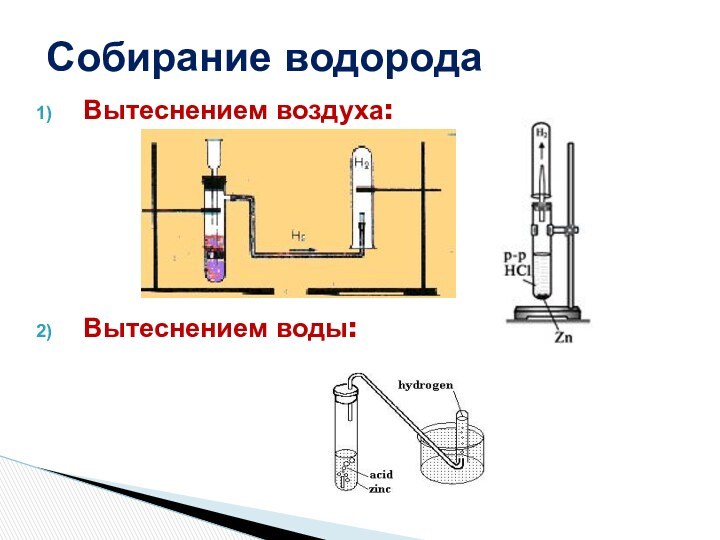
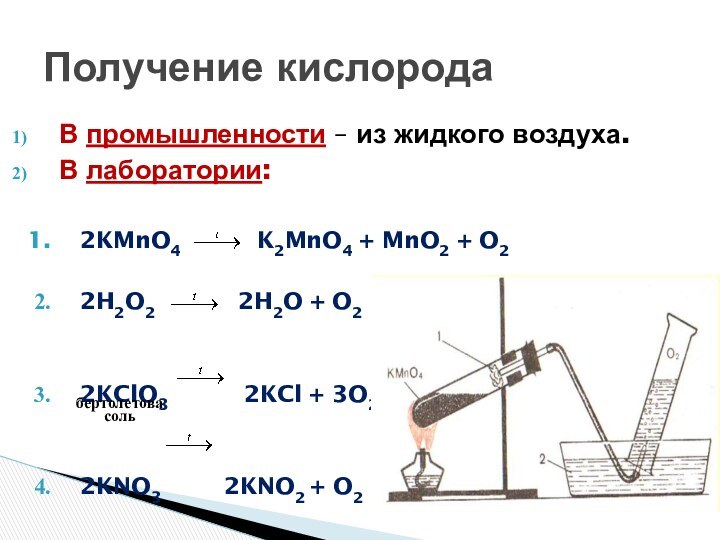
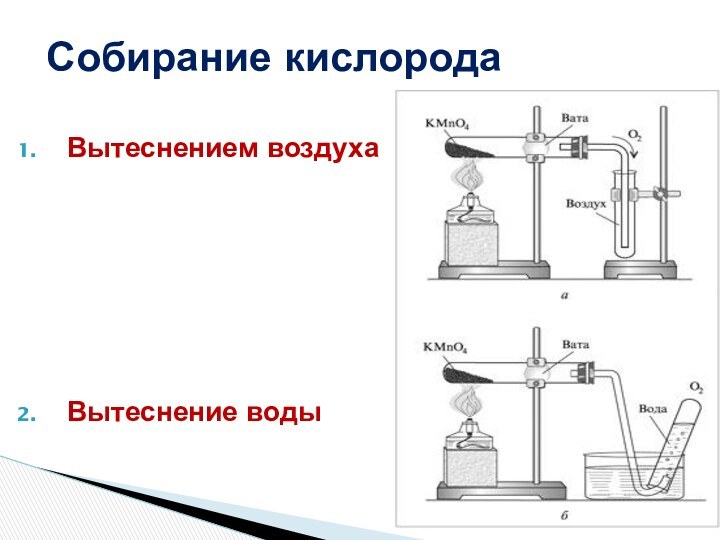
распространение их в природе
вспомнить уравнения горения простых и сложных
веществпознакомиться со способами получения газов в лаборатории и промышленности
рассмотреть способы собирания и распознавания водорода и кислорода
узнать области применения этих газов
Цели урока