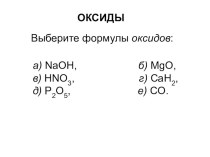
Fe → FeSO4 + H2;
2H2SO4 + Cu →
CuSO4 + SO2 +2H2O - в этом случае кислота является концентрированной. - химическая реакция с оксидами металлов:
H2SO4 + CuO → CuSO4 + H2O
Получающийся раствор синего цвета - CuSO4 - раствор медного купороса. Серную кислоту еще называют купоросным маслом, так как при реакциях с металлами и их оксидами образуются купоросы. Например, при химической реакции с железом (Fe) - образуется светло-зелёный раствор железного купороса.
- химическая реакция с основаниями и щелочами (или реакция нейтрализации)
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- химическая реакция с серой (кислота - концентрированная, реакция - при нагревании):
2H2SO4 + S → 3SO2 + 2H2O
- химическая реакция с солями (например, со стиральной содой Na2CO3):
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O