- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Понятия и законы в химии. (Лекция 1)
Содержание
- 2. Лекция №1 Основные понятия и
- 3. Основные положения атомно-молекулярного ученияВсе вещества состоят из атомов, молекул или ионов.
- 4. Основные положения атомно-молекулярного учения Атом – микроскопическая
- 5. Основные положения атомно-молекулярного учения Химический элемент – вид атомов, имеющих одинаковый заряд ядер.
- 6. Основные положения атомно-молекулярного ученияМолекула – наименьшая частица вещества, состоящая из соединенных между собой атомов.Электронейтральна.
- 7. Основные положения атомно-молекулярного ученияИон – электрически
- 8. Основные положения атомно-молекулярного ученияАтомы одного элемента
- 9. Основные положения атомно-молекулярного ученияАллотропия существование химического
- 10. Аллотропия
- 11. Аллотропия
- 12. Основные положения атомно-молекулярного ученияПри химическом взаимодействии
- 13. Основные положения атомно-молекулярного ученияПри физических явлениях молекулы сохраняются, при химических – разрушаются.
- 14. Основные положения атомно-молекулярного ученияВсе молекулы, атомы
- 15. Основные величины Относительная атомная масса элемента (Ar)
- 16. Основные величиныКоличество вещества (n) – число структурных единиц (атомов, молекул, ионов), образующих это вещество (моль)
- 17. Основные величиныМоль – количество вещества, содержащее столько
- 18. Основные величины 6,02 х 1023 моль-1 – NА - постоянная Авогадро
- 19. Основные величины Мольная масса вещества (М) – масса
- 20. Основные величиныЭквивалент элемента (Э) – количество элемента,
- 21. Основные величиныВалентность – способность атомов элемента к образованию химических связей Римские числа
- 22. Основные величиныСтепень окисления - условный заряд атома
- 23. Основные величины Массовая доля элемента (W): W = Ar элемента х количество атомов / Mr соединения
- 24. Физические явления- явления, при которых изменяется форма
- 25. Химические реакции – явления, при которых одни
- 26. Классификация химических реакцийвыделение или поглощение теплоты Н2
- 27. Классификация химических реакцийизменение числа исходных и конечных веществ:Соединения А+В=АВРазложения АВ=А+ВЗамещения АВ+С=АС+ВОбмена АВ+СД=АД+СВ
- 28. Реакции соединения
- 29. Реакции разложения
- 30. Реакции замещения
- 31. Реакции обмена
- 32. Классификация химических реакцийобратимость реакцииобратимыенеобратимые
- 33. Обратимые реакцииN2 + O2 ↔ 2NO обратимая, т.к. одновременно протекает в двух взаимно противоположных направлениях
- 34. Необратимые реакцииBaCl2 + H2SO4 = BaSO4↓ +
- 35. Скачать презентацию
- 36. Похожие презентации
Лекция №1 Основные понятия и законы химии Химия – наука о веществах и превращениях их друг в друга

































Слайд 3
Основные положения
атомно-молекулярного учения
Все вещества состоят из атомов,
молекул или ионов.
Слайд 4
Основные положения
атомно-молекулярного учения
Атом
– микроскопическая частица вещества,
наименьшая часть химического элемента, являющаяся носителем его свойств.
Электронейтрален.
Слайд 5
Основные положения
атомно-молекулярного учения
Химический элемент
– вид атомов,
имеющих одинаковый заряд ядер.
Слайд 6
Основные положения
атомно-молекулярного учения
Молекула
– наименьшая частица вещества,
состоящая из соединенных между собой атомов.
Электронейтральна.
Слайд 7
Основные положения
атомно-молекулярного учения
Ион
– электрически заряженная частица,
образующаяся при отдаче или приобретении е.
(Н+ - катион,
Сl- - анион)
Слайд 8
Основные положения
атомно-молекулярного учения
Атомы одного элемента сходны друг
с другом,
но отличаются от атомов другого элемента.
Слайд 9
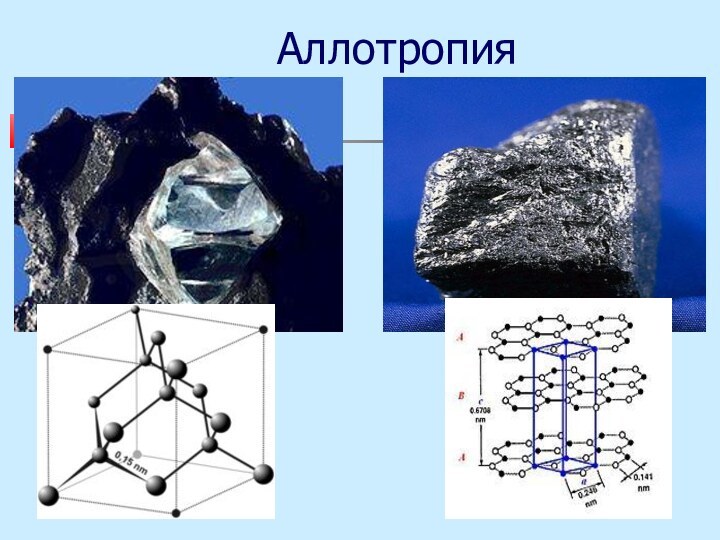
Основные положения
атомно-молекулярного учения
Аллотропия
существование химического элемента в
виде нескольких простых веществ
Белый и черный фосфор –
различное число атомов;Алмаз и графит – разное строение кристаллов.
Слайд 12
Основные положения
атомно-молекулярного учения
При химическом взаимодействии атомов образуются
молекулы:
гомоядерные
(при взаимодействии атомов одного элемента)
гетероядерные
(при
взаимодействии атомов разных элементов).
Слайд 13
Основные положения
атомно-молекулярного учения
При физических явлениях молекулы сохраняются,
при химических – разрушаются.
Слайд 14
Основные положения
атомно-молекулярного учения
Все молекулы, атомы и ионы
находятся в непрерывном движении.
Химические реакции
заключаются в образовании новых
веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Слайд 15
Основные величины
Относительная атомная масса элемента (Ar)
–
отношение массы его атома к 1\12 части массы атома
углерода (12С)Относительная молекулярная масса (Mr)
– …его молекулы… Сумма Ar
Величины безразмерные
Слайд 16
Основные величины
Количество вещества (n)
– число структурных единиц
(атомов, молекул, ионов),
образующих это вещество
(моль)
Слайд 17
Основные величины
Моль
– количество вещества,
содержащее столько структурных
единиц, сколько содержится атомов
в 12 г. углерода (12С).
Слайд 19
Основные величины
Мольная масса вещества (М) – масса одного
моль вещества
(численно равна Аr или Mr) (г\моль)
m =
n х M
Слайд 20
Основные величины
Эквивалент элемента (Э) – количество элемента, которое
соединяется с 1 молем атома водорода
Эквивалентная масса –
масса 1 Э веществаЭквивалентный объем – V, занимаемый 1 Э вещества
Слайд 21
Основные величины
Валентность
– способность атомов элемента
к образованию
химических связей
Римские числа
Слайд 22
Основные величины
Степень окисления
- условный заряд атома
в
соединении
Арабские числа, включая «0»,
со знаками «+» или
«-»
Слайд 23
Основные величины
Массовая доля элемента (W):
W = Ar элемента
х количество атомов / Mr соединения
Слайд 24
Физические явления
- явления, при которых изменяется форма (ковка
металла)
или физическое состояние веществ (вода в лед или
пар) или образуются новые вещества за счет изменения состава ядер атомов
Слайд 25
Химические реакции
– явления, при которых одни вещества
превращаются в другие, отличающиеся от исходных составом и свойствами
(но не происходит изменение состава ядер атомов)
Слайд 26
Классификация химических реакций
выделение или поглощение теплоты
Н2 +
СL2 = 2 HCL + 184,6 кДж (экзотермическая)
N2 +
O2 = 2 NO - 180,8 кДж (эндотермическая)
Слайд 27
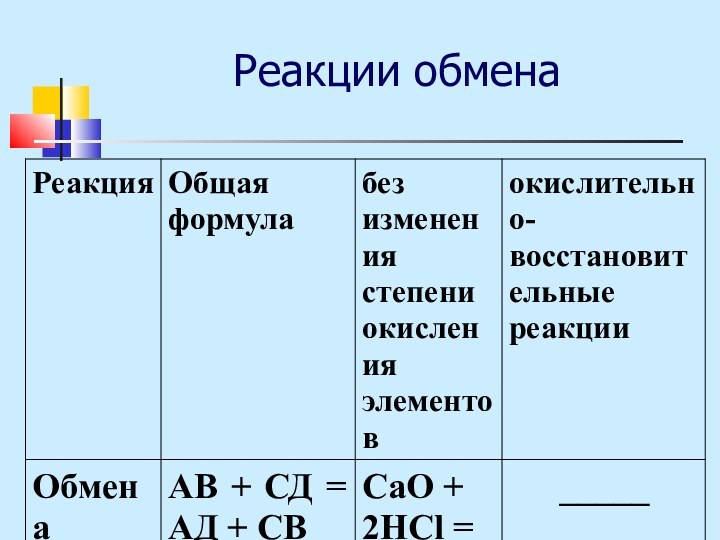
Классификация химических реакций
изменение числа исходных и конечных веществ:
Соединения
А+В=АВ
Разложения АВ=А+В
Замещения АВ+С=АС+В
Обмена АВ+СД=АД+СВ
Слайд 33
Обратимые реакции
N2 + O2 ↔ 2NO
обратимая,
т.к.
одновременно протекает в двух взаимно противоположных направлениях
Слайд 34
Необратимые реакции
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
(продукты выпадают в виде осадка)
2KClO3 = 2KCl + 3O2↑
(продукты выделяются в виде газа)
2Mg + O2 = 2MgO
(сопровождается большим выделением Е)