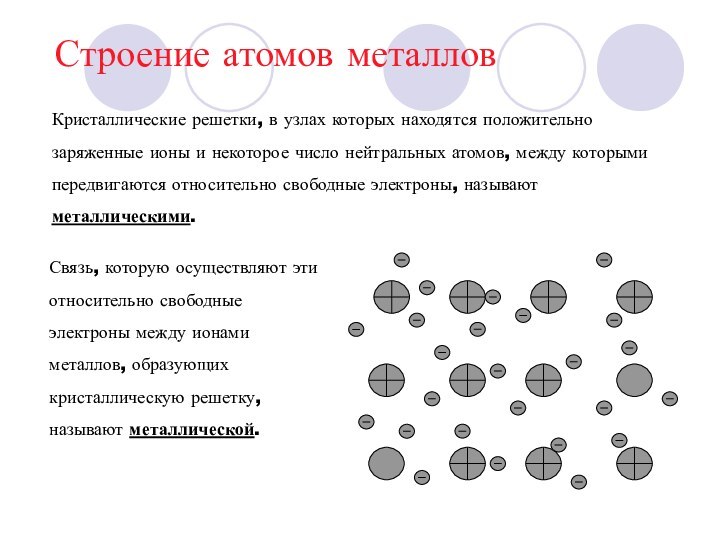
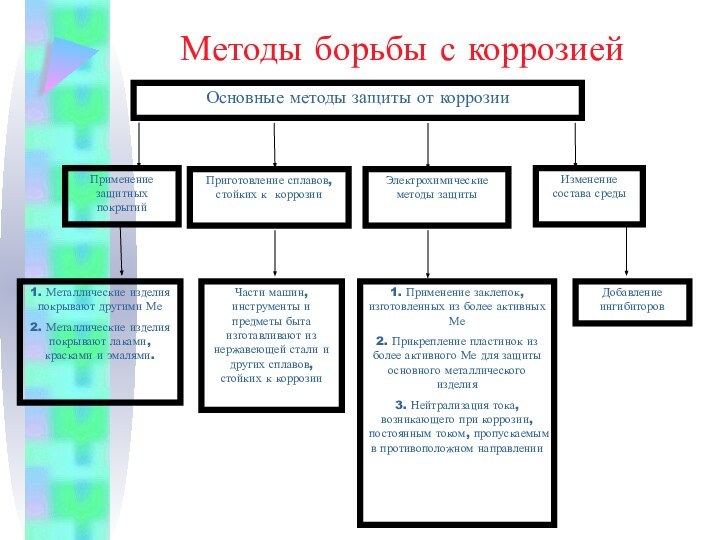
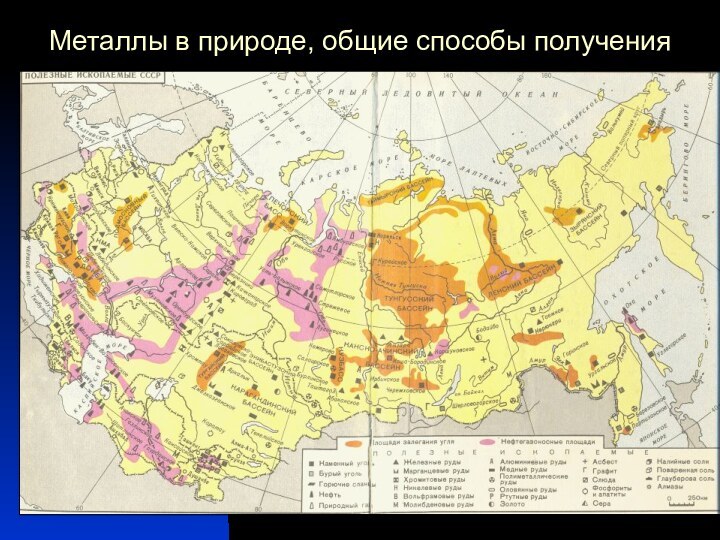
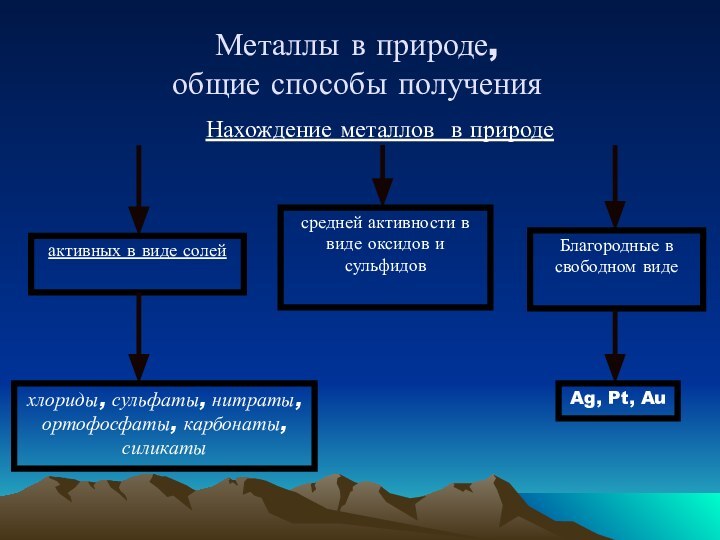
серый цвет и непрозрачность, что связано с наличием свободных
электронов.
2) Тот факт, что металлы обладают хорошей электрической проводимостью, объясняется присутствием в них свободных электронов, которые под влиянием даже небольшой разности потенциалов приобретают направленное движение от отрицательного полюса к положительному.
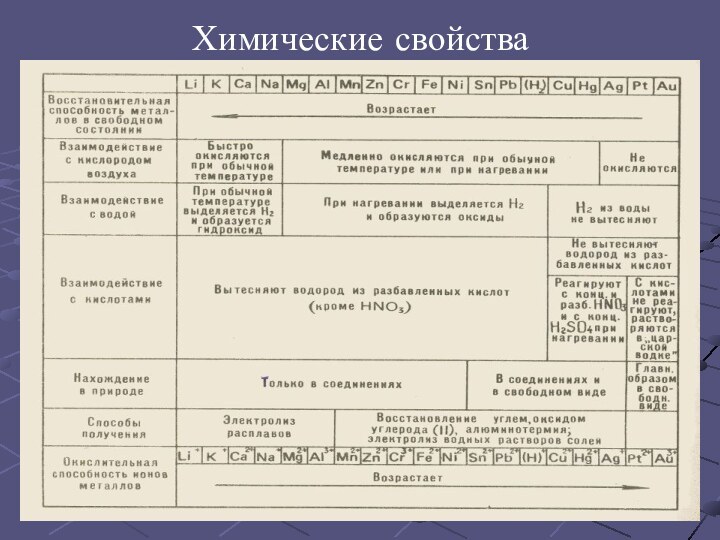
С повышением температуры увеличивается колебания атомов (ионов), что затрудняет направленное движение электронов и тем самым приводит к уменьшению электрической проводимости. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость резко возрастает. Наибольшей электрической проводимостью обладает серебро и медь. За ними следуют золото, алюминий, железо. Наряду с медными изготавливаются и алюминиевые провода.
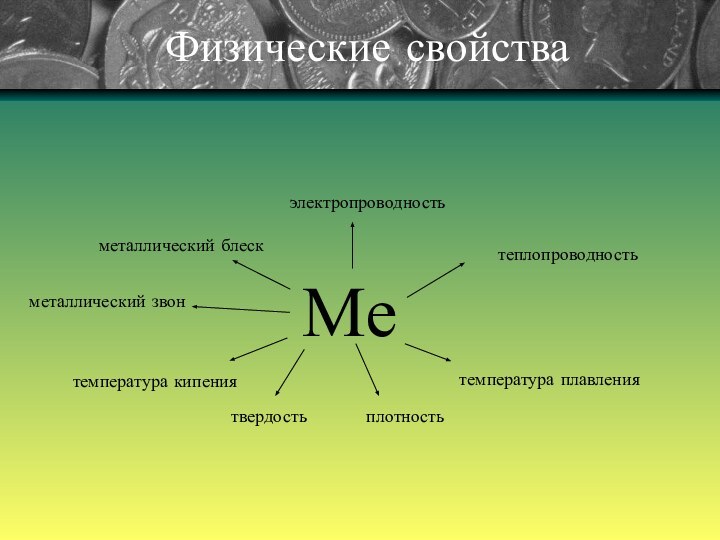
Физические свойства (продолжение)
Электрический ток – это упорядоченное (направленное) движение заряженных частиц.