Слайд 2
Положение неметаллов в ПС Д.И.Менделеева.
Неметаллы расположены в правом
верхнем углу ПС (вдоль и над диагональю B-At).
Всего
22 элемента- неметалла в Периодической системе
Элементы-неметаллы располагаются только в главных подгруппах ПС.
Слайд 3
Особенности атомного строения элементов-неметаллов.
Для атомов-неметаллов характерно:
Небольшой атомный радиус
( в сравнении с радиусами атомов-металлов одного с ними
периода).
Большее число электронов на внешнем уровне (4-8), исключения Н, Не, В.
Происходит заполнение электронами только внешнего энергетического уровня.
Для элементов-неметаллов характерны высокие значения электроотрицательности.
Слайд 4
Характеристика простых веществ-неметаллов.
Для неметаллов
- простых веществ более характерно различие свойствах (физических и
химических), чем их общность. Разнообразие свойств неметаллов объясняется, тем, что неметаллы могут иметь два типа кристаллической решетки: молекулярную (все газы, белый фосфор, сера, йод) и атомную (бор, кристаллический кремний, алмаз, графит). Для сравнения – металлы имеют металлическую кристаллическую решетку.
Слайд 5
Физические свойства простых веществ – неметаллов.
Для неметаллов (простых
веществ) характерны все 3 агрегатных состояния при обычных условиях
(сравнить – все металлы, кроме ртути, в обычных условиях твердые вещества)
Твердые вещества: различные модификации серы, йод кристаллический, графит, фосфор, уголь активированный, кристаллический или аморфный кремний, бор (единственное жидкое при обычных условиях простое вещество – это бром).
Газообразные вещества – неметаллы – это О2, N2, H2, Cl2, F2.
Слайд 6
Для неметаллов характерна разнообразная цветовая гамма: белый ,черный
,красный фосфор, красно-бурый бром, желтая сера, фиолетовый йод, черный
графит, алмазы разного цвета, бесцветный – кислород, азот, водород (тогда как абсолютное большинство металлов имеют серебристо-белый цвет).
Температуры плавления: от 38000 С (графит) до -2100 С (азот). Для сравнения – металлы: от 33800 С (вольфрам) до -38,90 С (ртуть).
Некоторые неметаллы электропроводны (графит, кремний), имеют металлический блеск (йод, графит, кремний). По этим признакам напоминают металлы, но все они – хрупкие вещества.
Слайд 7
Аллотропия.
Среди неметаллов распространено явление аллотропии. Один элемент может
образовывать несколько простых веществ.
Причины аллотропии:
Разные типы кристаллических решеток (белый
фосфор Р4 – молекулярная, красный фосфор Р – атомная).
Разная структура кристаллической решетки (алмаз – тетраэдрическая, графит – слоистая).
Разный состав молекул аллотропных модификаций (О2 и О3).
Слайд 8
Кислород О2 и озон О3
Кислород- газ, без цвета,
вкуса и запаха, плохо растворим в воде, в жидком
состоянии светло-голубой, в твердом – синий.
Озон- светло-синий газ, темно-голубая жидкость, в твердом состоянии темно-фиолетовый, имеет сильный запах, в 10 раз лучше, чем кислород, растворим в воде.
Слайд 9
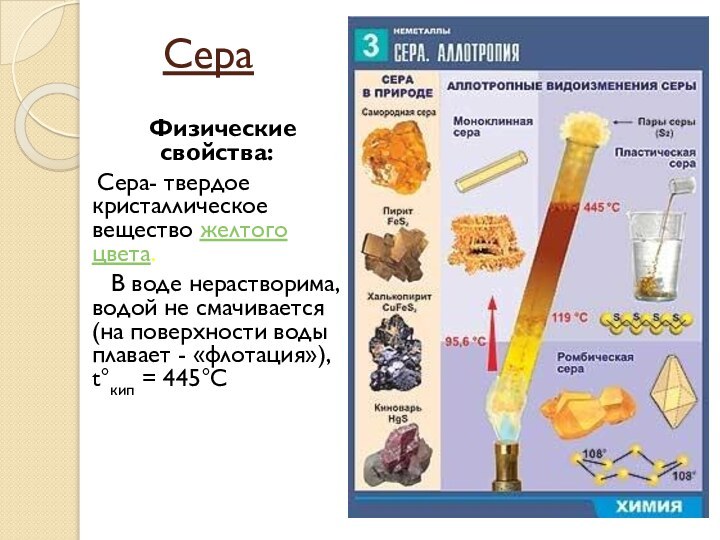
Сера
Физические свойства:
Сера- твердое кристаллическое вещество желтого цвета.
В воде нерастворима, водой не смачивается (на поверхности воды плавает - «флотация»), t°кип = 445°С
Слайд 10
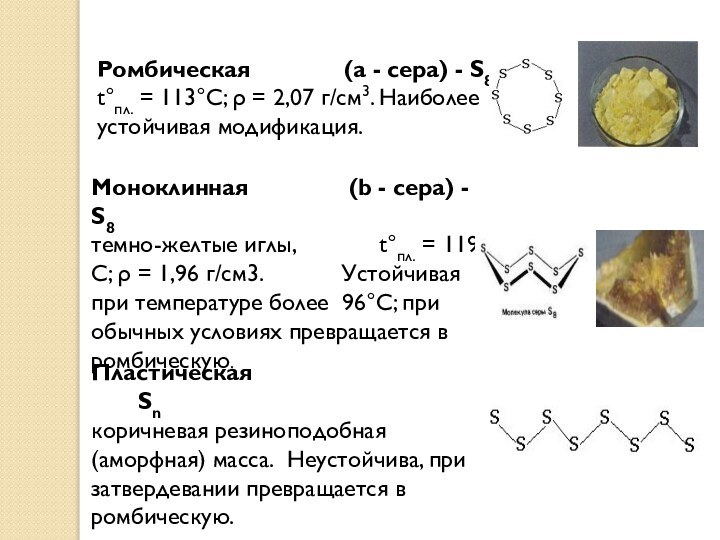
Ромбическая (a - сера) - S8
t°пл. = 113°C;
ρ = 2,07 г/см3. Наиболее устойчивая модификация.
Моноклинная (b -
сера) - S8
темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.
Слайд 11
Фосфор
Элементарный фосфор
в обычных условиях представляет собой несколько устойчивых аллотропических модификаций;
вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.
Слайд 12
Биологическая роль соединений фосфора
Фосфор присутствует в
живых клетках в виде орто- и пирофосфорной кислот, входит
в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Слайд 13
Белый, красный, чёрный и металлический фосфор
Слайд 14
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за
примесей может иметь желтоватый оттенок). По внешнему виду он
очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярное строение; формула P4.
Химически белый фосфор чрезвычайно активен, медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение) ; ядовит.
Открыт гамбургским алхимиком Хеннигом Брандом в 1669 году
Слайд 15
Красный фосфор
Красный фосфор имеет формулу Рn и представляет
собой полимер со сложной структурой.
Имеет оттенки от пурпурно-красного
до фиолетового, а в литом состоянии - тёмно-фиолетовый с медным оттенком, имеет металлический блеск.
Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость.
Ядовитость его в тысячи раз меньше, чем у белого.
Получен в 1847 году в Швеции австрийским химиком А. Шрёттером
Слайд 16
Чёрный фосфор
Чёрный фосфор представляет собой чёрное вещество с
металлическим блеском, жирное на ощупь и весьма похожее на
графит, и с полностью отсутствующей растворимостью в воде или органических растворителях.
Проводит электрический ток и имеет свойства полупроводника.
Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом
Слайд 17
Металлический фосфор
При 8,3·1010 Па чёрный фосфор переходит в
новую, ещё более плотную и инертную металлическую фазу с
плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Слайд 18
Свободный углерод
В свободном виде углерод встречается в нескольких
аллотропных модификациях – алмаз, графит, карбин, крайне редко фуллерены.
В лабораториях также были синтезированы многие другие модификации: новые фуллерены, нанотрубки, наночастицы и др.
Слайд 19
Алмаз
Бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже
всех найденных в природе веществ, но при этом довольно
хрупок. Он настолько тверд, что оставляет царапины на большинстве материалов.
Плотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС. Алмаз можно получить из графита при p > 50 тыс. атм. и tо = 1200оC В алмазе каждый 4-х валентный атом углерода связан с другим атомом углерода ковалентной связью и количество таких связанных в каркас атомов чрезвычайно велико.
Слайд 20
Куллинан
(алмаз)-
621,35 грамма,
размеры:
100х65х50 мм
Бриллианты: Куллинан-1, Куллинан-2, Куллинан-3 и 4
Слайд 21
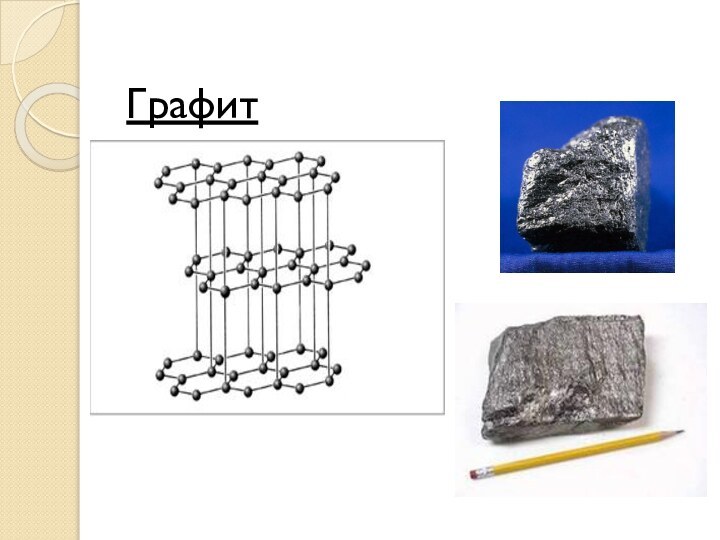
Графит
Графит – устойчивая при нормальных условиях аллотропная
модификация углерода, имеет серо-черный цвет и металлический блеск, кажется
жирным на ощупь, очень мягок и оставляет черные следы на бумаге.
Атомы углерода в графите расположены отдельными слоями, образованными из плоских шестиугольников. Каждый атом углерода на плоскости окружен тремя соседними, расположенными вокруг него в виде правильного треугольника.
Графит характеризуется меньшей плотностью и твердостью, а также графит может расщепляться на тонкие чешуйки. Чешуйки легко прилипают к бумаге – вот почему из графита делают грифели карандашей.
В пределах шестиугольников возникает склонность к металлизации, что объясняет хорошую тепло- и электропроводность графита, а также его металлический блеск.
Слайд 23
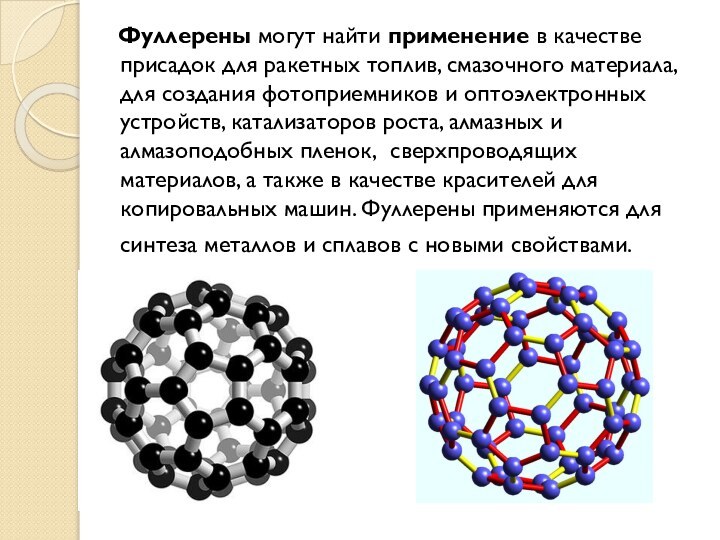
Фуллерены
Фуллерены – класс химических соединений, молекулы которых состоят
только из углерода, число атомов которого четно, от 32
и более 500, они представляют по структуре выпуклые многогранники, построенные из правильных пяти- и шестиугольников.
Третья форма чистого углерода является молекулярной. Это означает, что минимальным элементом ее структуры является не атом, а молекула углерода, представляющая собой замкнутую поверхность, которая имеет форму сферы.
В фуллерене плоская сетка шестиугольников (графитовая сетка) свернута и сшита в замкнутую сферу. При этом часть шестиугольников преобразуется в пятиугольники. Образуется структура – усеченный икосаэдр. Каждая вершина этой фигуры имеет трех ближайших соседей. Каждый шестиугольник граничит с тремя шестиугольниками и тремя пятиугольниками, а каждый пятиугольник граничит только с шестиугольниками.
Слайд 24
Фуллерены могут найти применение в качестве
присадок для ракетных топлив, смазочного материала, для создания фотоприемников
и оптоэлектронных устройств, катализаторов роста, алмазных и алмазоподобных пленок, сверхпроводящих материалов, а также в качестве красителей для копировальных машин. Фуллерены применяются для синтеза металлов и сплавов с новыми свойствами.
Слайд 25
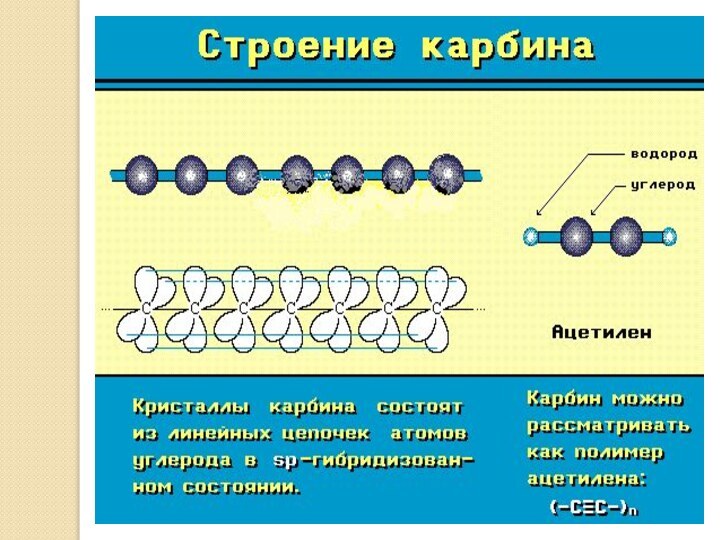
Карбин
Карбин конденсируется в виде белого углеродного
осадка на поверхности при облучении пирографита лазерным пучком света.
Кристаллическая форма карбина состоит из параллельно ориентированных цепочек углеродных атомов с sp-гибридизацией валентных электронов в виде прямолинейных макромолекул полиинового ( -С= С-С= С-... ) или кумуленового (=С=С=С=...) типов.