- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Химические свойства кислот (8 класс)
Содержание
- 2. Что нас объединяет?
- 3. Кислоты — это сложные вещества, состоящие из атомов водорода и кислотного остатка.
- 4. Формулы, каких веществ «лишние» и почему?1)HCI
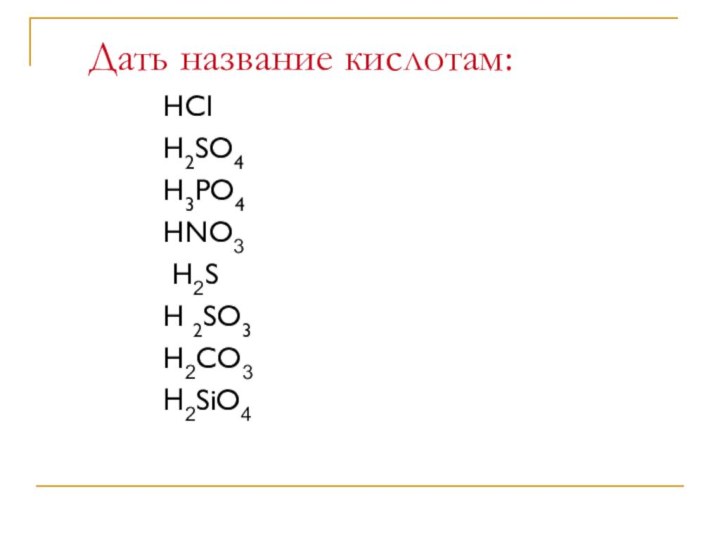
- 5. Дать название кислотам:HCIH2SO4
- 6. КЛАССИФИКАЦИЯ КИСЛОТ. бескислородные
- 7. 2. По количеству атомов водорода.КИСЛОТЫодно-основныеHClHNO3двух-основныеH2SH2SO4трех-основныеH3PO4
- 8. Станция 1. ИСТОРИЧЕСКАЯ На первых этапах развития
- 9. Правила техники безопасности при работе с кислотами:
- 10. Станция 3. « ИНДИКАТОРНАЯ»Индикатор лакмус красный
- 11. Химические свойства кислот КИСЛОТА +СОЛЬМеталлОсновный оксидОснованиеСоль+ Н2Н2ОН2Окислота
- 12. Химические свойства кислот взаимодействие с металлами
- 13. Кислота + основной оксид = соль
- 14. Кислота + основнование = соль +
- 15. Кислота 1 + соль1 = соль2
- 16. Закрепление
- 17. Задание. Составьте возможные уравнения реакций перечисленных веществ
- 18. Скачать презентацию
- 19. Похожие презентации














Слайд 4
Формулы, каких веществ «лишние» и почему?
1)HCI 2)CO2
3)NaOH 4) H2SO4
5)
NaCI 6) H3PO4 7) HNO3 8) H2S 9) СаО 10) H2CO3 11)Н2О
12)Н2SiO4
Слайд 6
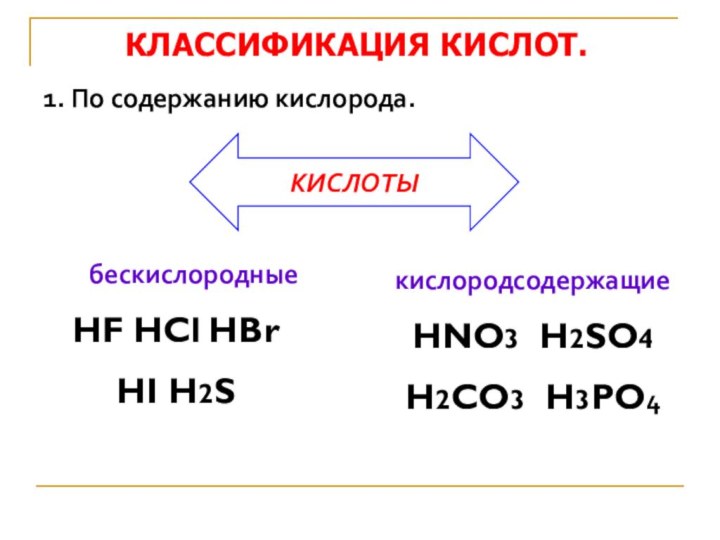
КЛАССИФИКАЦИЯ КИСЛОТ.
бескислородные
HF HCl HBr
HI H2S
1. По содержанию
кислорода.кислородсодержащие
HNO3 H2SO4
H2CO3 H3PO4
КИСЛОТЫ
Слайд 7
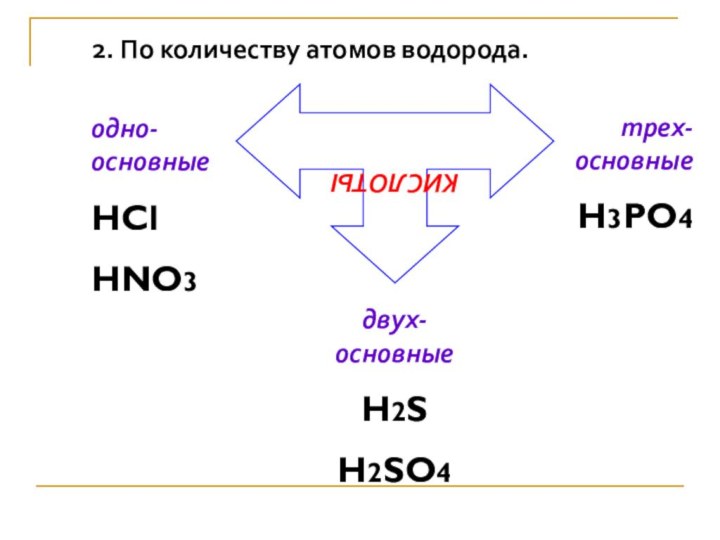
2. По количеству атомов водорода.
КИСЛОТЫ
одно-основные
HCl
HNO3
двух-основные
H2S
H2SO4
трех-основные
H3PO4
Слайд 8 Станция 1. ИСТОРИЧЕСКАЯ На первых этапах развития химии определение
понятия «кислота» базировалось на экспериментально установленных свойствах, а не на
их составе. Так в 17 веке существовала теория Ламери, в которой свойства кислот растворять металлы объяснялась тем, что частицы имеют острые концы которыми они внедряются в частицы металлов. На смену этой теории пришла кислородная теория, которую выдвинул в 1778 году Лаувазье. По этой теории в состав кислот входит Оксиген, который и обуславливает особые свойства кислот. Однако после того как Гей-Люсаком было установлено, что не все кислоты имеют в своём составе Оксиген эта теория была опровергнута. В 1814 году выдающийся ученый Деви в своей водородной теории кислот установил, что свойства кислот обуславливает наличие в них атомов Гидрогена. Становлению этой теории помогли труды химиков Грема и Либиха.Слайд 9 Правила техники безопасности при работе с кислотами: 1. Большинство
кислот кислые на вкус, однако пробовать химические вещества на
вкус запрещено. 2. Помните! В связи с выделением большого количества теплоты при растворении кислоты
в воде к ней воду добавлять нельзя. В таком случае вода, которая имеет меньшую плотность окажется на поверхности, закипит и её брызги вместе с кислотой, попадут наружу.
В случае попадания кислоты на кожу следует промыть водой, раствором соды либо мылом.
Сначала вода, потом кислота – иначе будет большая беда!
Станция 2
Слайд 10
Станция 3. « ИНДИКАТОРНАЯ»
Индикатор лакмус красный
Кислоту укажет ясно.
Когда ж нейтральная среда,
Он фиолетовый всегда.Универсальный индикатор - розовый
Слайд 12
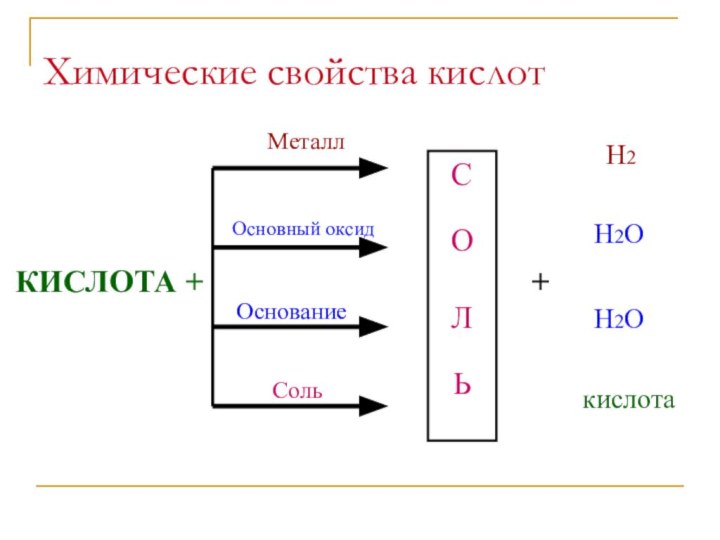
Химические свойства кислот
взаимодействие с металлами
Кислота +
металл = соль + водород
Ряд активности металлов:
Li K Ba
Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt AuОпыт 1. Взаимодействие магния с соляной кислотой
Опыт 2. Взаимодействие цинка с соляной кислотой
Опыт 3. Взаимодействие меди с соляной кислотой
Слайд 13 Кислота + основной оксид = соль +
вода
Химические свойства кислот
взаимодействие с основными
оксидами
Опыт. Взаимодействие оксида меди(II)
с серной кислотой.
Слайд 14
Кислота + основнование = соль + вода
Химические
свойства кислот
взаимодействие с основаниями
Опыт 1. Взаимодействие гидроксида калия с
соляной кислотой. Опыт 2. Взаимодействие гидроксида меди (II) с соляной кислотой.
Слайд 15 Кислота 1 + соль1 = соль2 +
Кислота 2
Химические свойства кислот
Взаимодействие с солями слабых кислот
Опыт 1.
Взаимодействие хлорида бария с серной кислотой. Опыт 2. Взаимодействие карбоната натрия с соляной
кислотой.
Слайд 16
Закрепление знаний
Про
какие химические свойства кислот вы сегодня узнали, перечислить.
Какими правилами
нужно пользоваться при работе с кислотами.Как правильно смешивать кислоту с водой
Слайд 17
Задание.
Составьте возможные уравнения реакций перечисленных веществ с
раствором серной кислоты.
I вариант – LiOH, SiO2
II вариант
– Ba(NO3)2, CuIII вариант – K2O, NaNO3
IV вариант – Mg, HCl





























