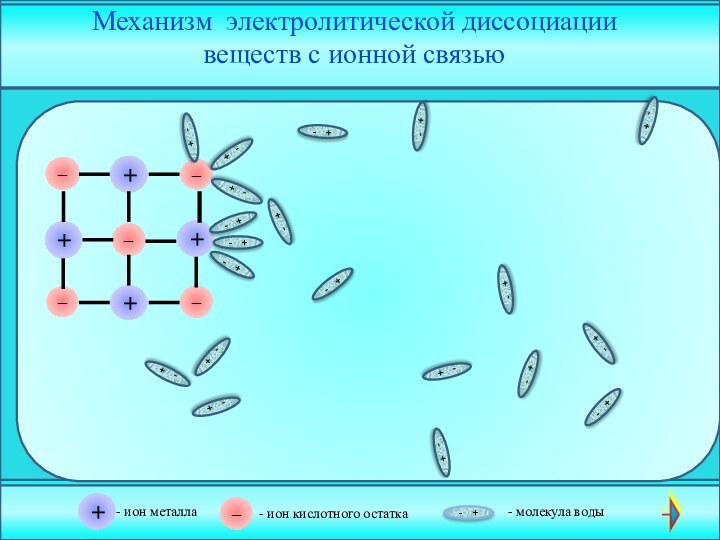
электролита на __________ .
Вопрос 1
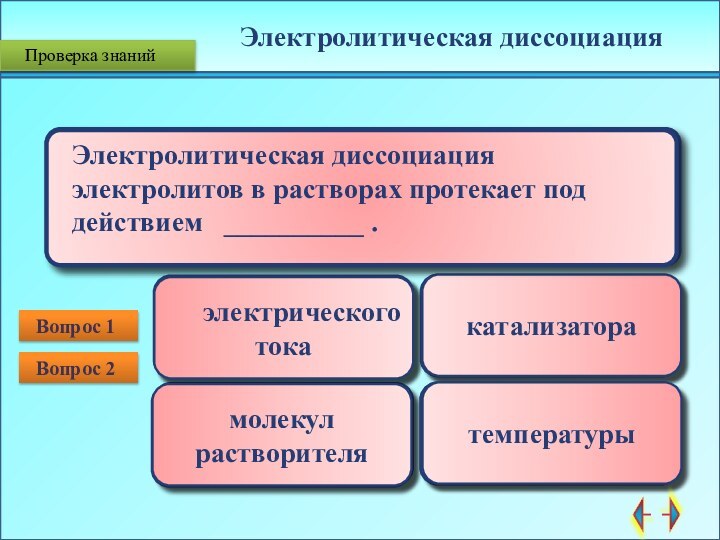
электрического
тока
катализатора
молекул растворителя
температуры
Электролитическая диссоциация
электролитов в растворах протекает под действием __________ . Вопрос 2
Электролитическая диссоциация
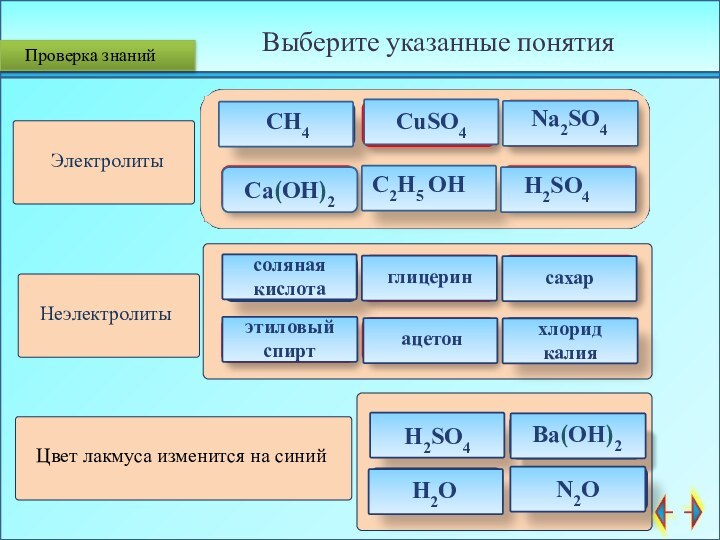
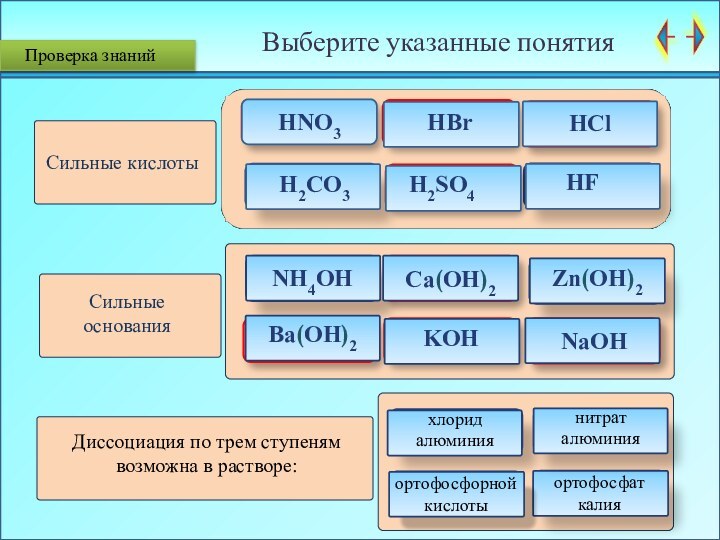
Проверка знаний

![ГИДРОЛИЗ СОЛЕЙ 11 класса Проверка знанийрН[H+][H+] ↔ [OH-]нейтральнаякислаящелочная[H+] = [OH-][H+] > [OH-][H+] < [OH-][H+]](/img/tmb/11/1078583/cdc52ee41b9f199cf4709babfd768ab3-720x.jpg)