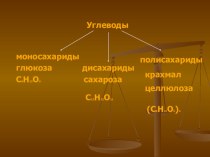
не растворяются в воде
При нагревании оксиды не разлагаются
При t°разлагаются
Гидроксиды
растворяются в воде
Гидроксиды не растворяются в воде
Гидроксиды разлагаются в воде
Гидроксиды при t° не разлагаются
Гидроксиды при t° разлагаются на воду и оксиды
При t° разлагаются
на Ме, Н2О и О2
Гидроксиды
Соли
Нитраты при t° разлагаются на нитриты и О2
Нитраты при t° разлагаются на оксид, NO2 и О2
Нитраты при t° разлагаются на Ме, NO2 и О2
Cоли, образованные сильными кислотами не гидролизуются
Cоли, образованные сильными кислотами, гидролизуются с образованием кислой среды
Cоли, образованные слабыми кислотами гидролизуются (среда щелочная).
Существующие и растворимые соли, образованные слабыми кислотами, гидролизуются полностью
Гидролиз солей
Главная