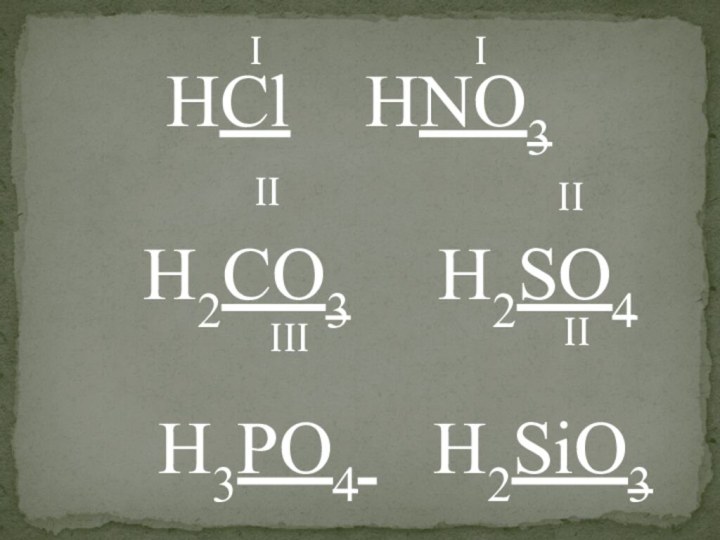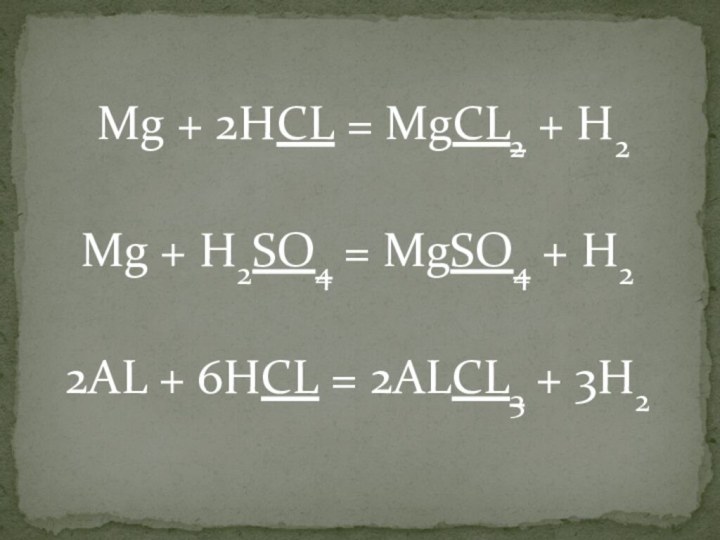их составе, классификации и химических свойствах.
Задачи:
- уметь определять
кислоты среди веществ других классов- уметь определять валентность кислотного остатка
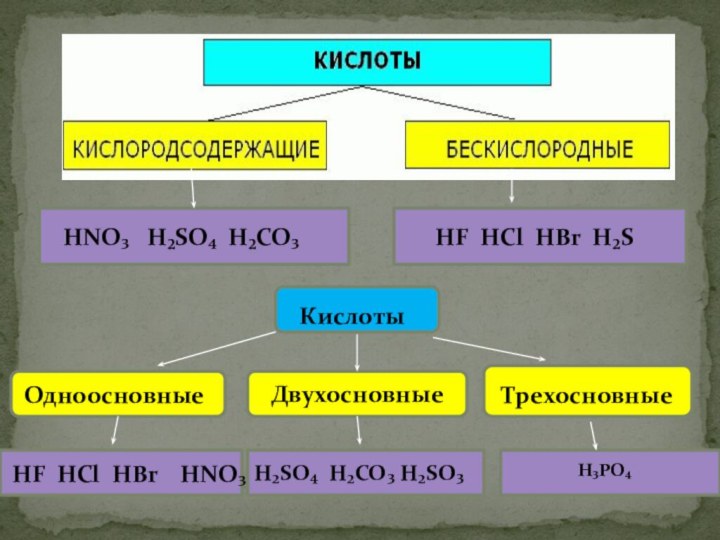
- уметь классифицировать кислоты по составу
- продолжить отработку экспериментальных умений при изучении химических свойств кислот
- сформировать понятие о вытеснительном ряде металлов
- научить пользоваться вытеснительным рядом при составлении уравнений
Тема урока «Кислоты: классификация, номенклатура, физические и химические свойства»