- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
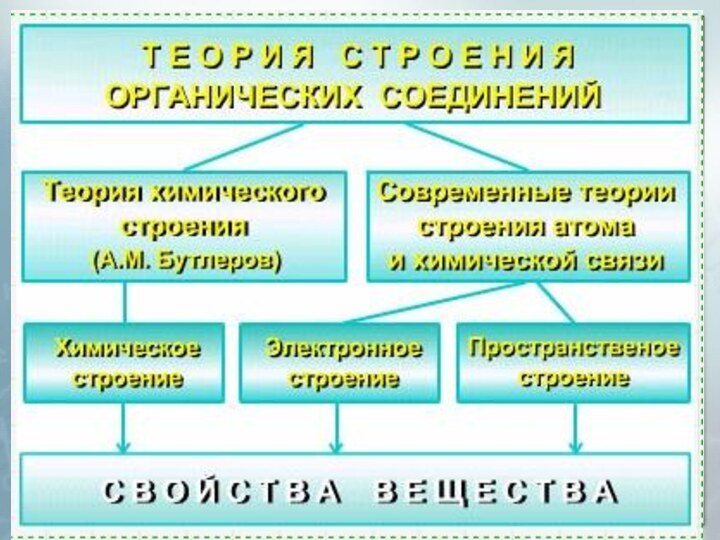
Презентация на тему Основы органической химии
Содержание
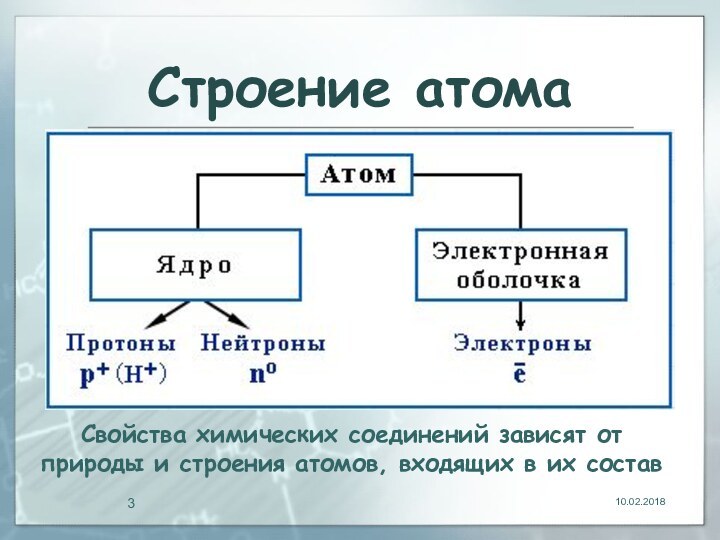
- 3. Строение атомаСвойства химических соединений зависят от природы и строения атомов, входящих в их состав
- 4. Свойства электронаЧасть пространства, в котором вероятность нахождения максимальна, называют орбиталью или электронным облаком
- 5. Атомная орбиталь (АО) – область наиболее вероятного пребывания электрона в электрическом поле ядра атома
- 6. Форма и энергия АОПервый уровень – 1s, второй – 2s
- 7. Форма и энергия АОВторой уровень – 2s, 2px,2py, 2pz
- 8. Заполнение атомных орбиталей электронамиПринцип устойчивости. АО заполняются
- 9. Принцип устойчивости
- 10. Заполнение атомных орбиталей электронамиПринцип Паули. На одной
- 11. Заполнение атомных орбиталей электронамиПравило Хунда. На АО
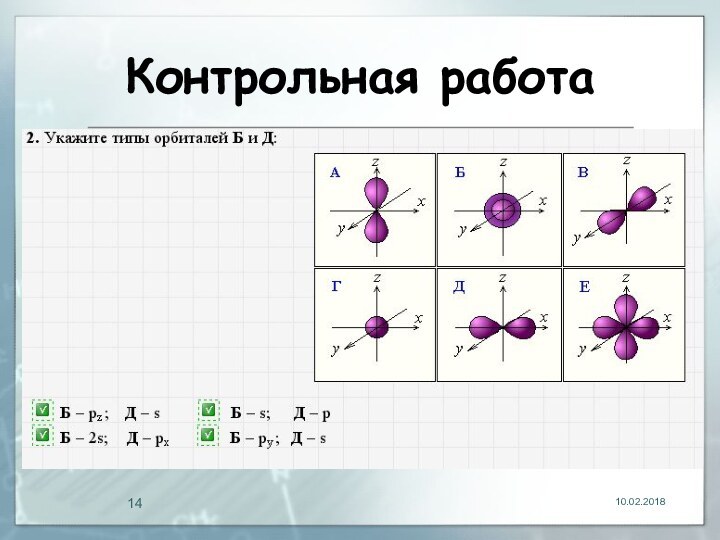
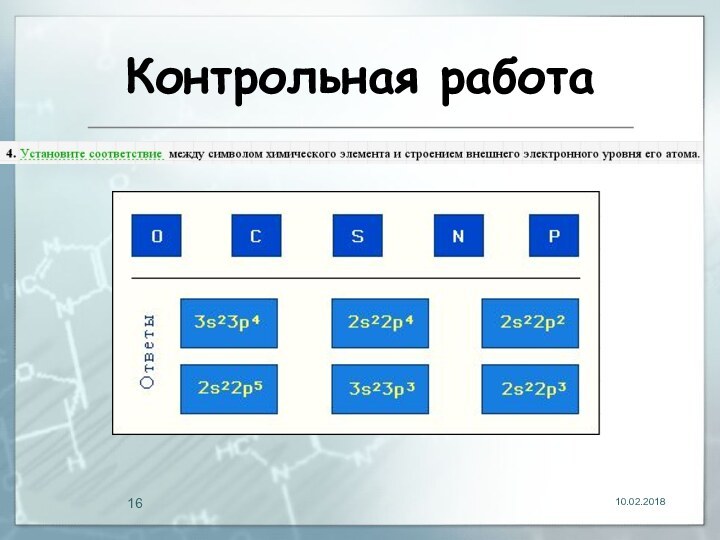
- 13. Контрольная работа
- 14. Контрольная работа
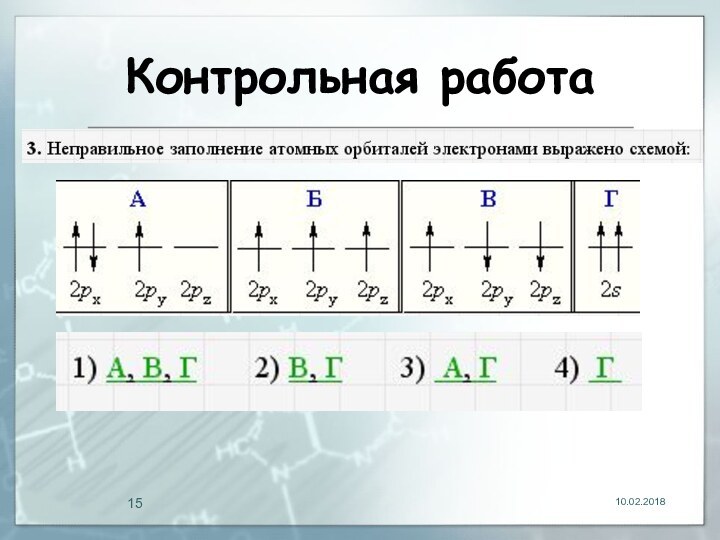
- 15. Контрольная работа
- 16. Контрольная работа
- 17. Контрольная работа
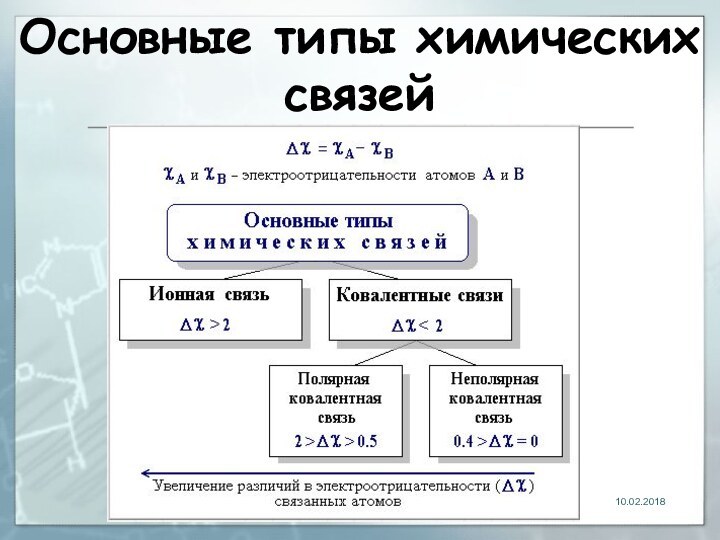
- 18. Основные типы химических связей
- 19. Ионная связь химическая связь, основанная на электростатическом
- 20. Электроотрицательность Способность атома удерживать внешние валентные электроныПодчиняется
- 21. Ковалентная связьСвязь, образованная путём обобществления пары электронов связываемых атомов
- 22. Свойства ковалентной связиНаправленностьНасыщаемостьПолярностьПоляризуемость
- 23. НаправленностьМолекулярное строение органических молекул имеет геометрическую форму.Количественной мерой направленности является угол между двумя связями (валентный угол)
- 24. Насыщаемость Способность атомов образовывать ограниченное число ковалентных связей.Количество связей определяется числом внешних атомных орбиталей атома.
- 25. Полярность Обусловлена неравномерным распределением электронной плотности вследствии различной электро-отрицательности атомов по шкале Л.Полинга:
- 26. Полярность Ковалентные связи делятся на полярные и неполярные. Неполярные связи между двумя одинаковыми атомами: Н—Н, С—С.
- 27. Полярность Полярные связи между двумя атомами с разной электроотрицательностью: Н—F, С—Сl.
- 28. Поляризуемость Смещение электронов под воздействием внешнего электрического поля другой частицы.
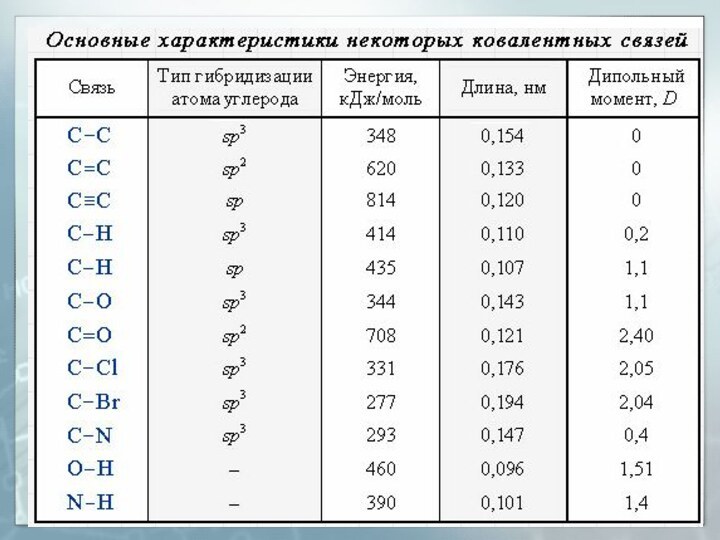
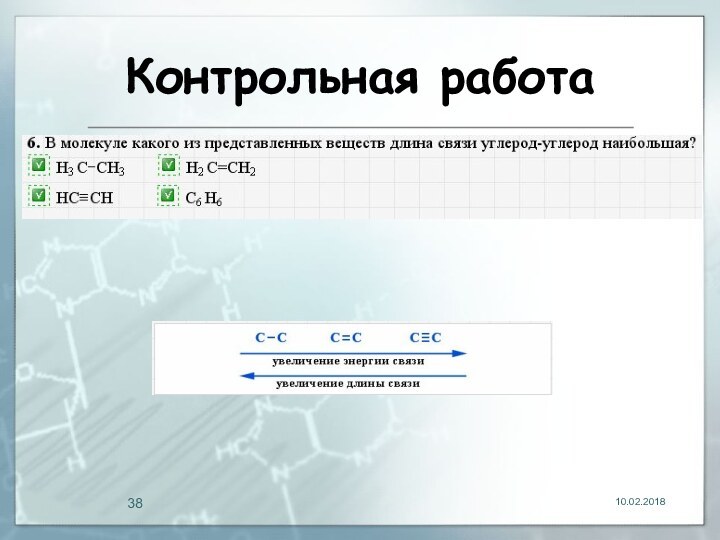
- 29. Длина связи Расстояние между центрами двух связанных атомов.На характеристики связей влияет их кратность
- 30. Энергия связи Энергия, выделяемая при образовании связи или необходимая для разъединения двух связанных атомов
- 31. Дипольный момент (μ или D) Величина, характеризующая полярность связи:l – длина связиq – эффективный заряд
- 33. Контрольная работа
- 34. Контрольная работа
- 35. Контрольная работа
- 36. Контрольная работа
- 37. Контрольная работа
- 38. Скачать презентацию
- 39. Похожие презентации
Строение атомаСвойства химических соединений зависят от природы и строения атомов, входящих в их состав