Слайд 2
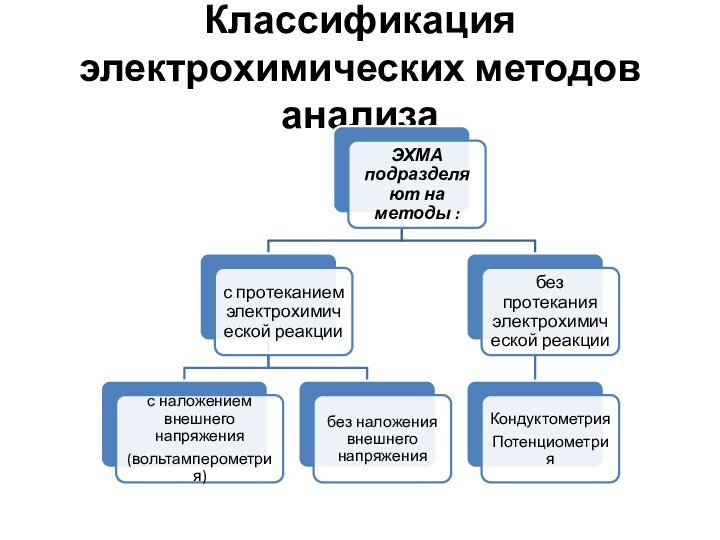
Классификация.
ЭХМА подразделяют на методы :
1. с протеканием
электрохимической реакции
2. без протекания электрохимической реакции
Первая группа методов
включает методы:
1.1.с наложением внешнего напряжения
1.2. без наложения внешнего напряжения
Слайд 3
Классификация электрохимических методов анализа
Слайд 4
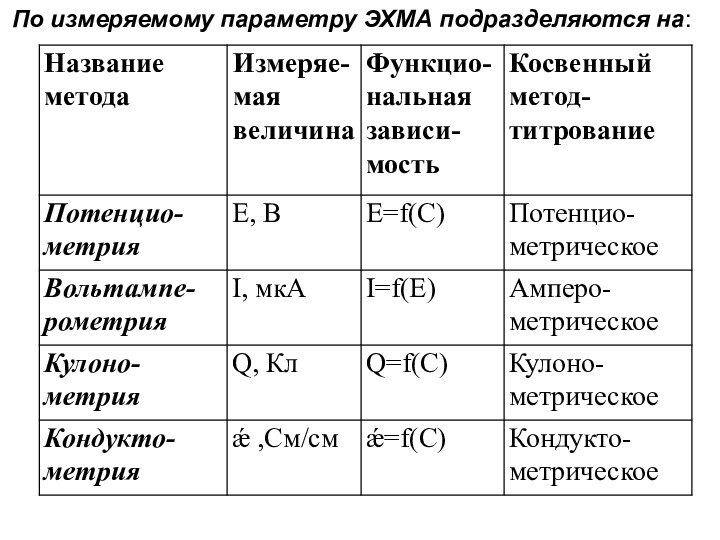
По измеряемому параметру ЭХМА подразделяются на:
Слайд 5
Основные понятия и термины.
Электрод - система из двух
электропроводящих фаз, одна из которых имеет электронную проводимость, а
другая - ионную.
Электроды подразделяют на индикаторные, вспомогательные и сравнения.
Пример электрода - металл, погруженный в раствор соли этого металла.
Слайд 6
Основные понятия и термины.
Потенциал электрода - это потенциал,
возникающий на границе раздела фаз вследствие образования двойного электрического
слоя. При отсутствии тока через электрод его потенциал имеет равновесное значение, определяемое по уравнению Нернста:
Слайд 8
Основные понятия и термины
Поляризация электрода - изменение значения
его потенциала при протекании через электрод электрического тока
Электрохимическая реакция
- гетерогенная реакция, в ходе которой электроны переходят через границу раздела фаз, то есть через электрод протекает электрический ток.
Слайд 9
ПОТЕНЦИОМЕТРИЯ
Определение: потенциометрия - метод определения концентрации веществ непосредственным
измерением потенциала индикаторного электрода по отношению к электроду сравнения.
Слайд 10
Типы электродов, используемых в потенциометрии
Индикаторные электроды:
окислительно-восстановительные электроды, например,
платиновый в контакте с окислительно-восстановительной системой
металлические - I, II
и III рода
мембранные ионселективные электроды
Слайд 11
окислительно-восстановительные электроды
Это инертные электроды, их потенциал обратимо зависит
от соотношения концентраций окислительно-восстановительной пары, присутствующей в растворе, согласно
уравнению Нернста, например, в растворе, содержащем Fe2+ и Fe3+, потенциал платинового электрода будет равен:
Слайд 12
Металлические электроды
I рода - металл в растворе своей
соли, например Ag в растворе AgNO3, Cu в растворе
CuSO4,
II рода - металл, покрытый своей малорастворимой солью и опущенный в раствор, содержащий анион этой соли, например Ag/AgCl/Cl-, Hg/Hg2Cl2/Cl-,
III рода - металл, покрытый малорастворимой солью и опущенный в раствор, содержащий другой катион, образующий малорастворимое соединение с этим анионом, например, ртутный электрод, опущенный в насыщенный раствор Hg2C2O4 и CaC2O4, содержащий избыток ионов кальция.
Слайд 13
Мембранные ионселективные электроды
изготовлены на основе твердых или
жидких мембран, главным свойством которых является проницаемость определенного вида
ионов в направлении от раствора с большей активностью этих ионов к раствору с меньшей активностью. В результате такого перемещения на поверхности мембраны возникает потенциал, препятствующий дальнейшему перемещению ионов, который будет зависеть от разности активностей ионов в растворе по обе стороны мембраны.
Слайд 14
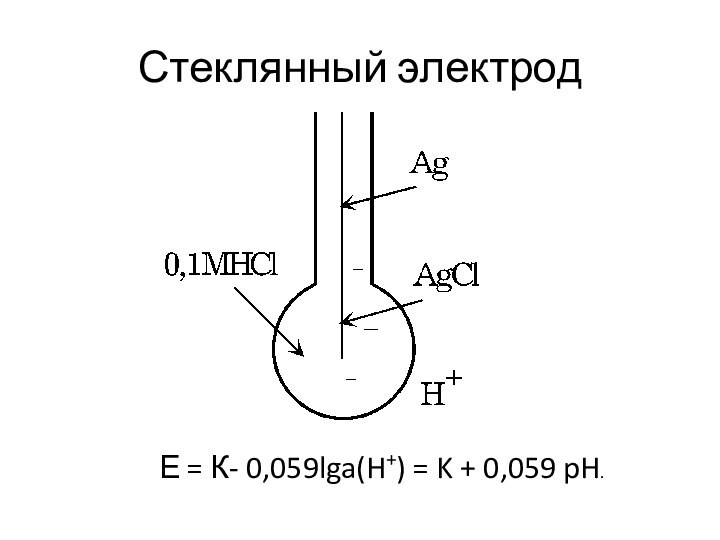
Стеклянный электрод
Е = К- 0,059lga(H+) = K +
0,059 pH.
Слайд 15
Типы электродов, используемых в потенциометрии
Электроды сравнения: электроды, потенциал
которых не зависит от концентрации ионов, участвующих в электродной
реакции, чтобы при измерении их потенциал всегда оставался постоянным. Этим требованиям удовлетворяют электроды II рода - хлоридсеребряный и каломельный
Слайд 16
Хлоридсеребряный электрод
потенциал этого электрода будет зависеть лишь
от концентрации хлорид-ионов, которую выбирают достаточно большой (обычно используют
насыщенные растворы КСl), и поэтому потенциал такого электрода при прохождении через него небольшого тока не меняется
Слайд 17
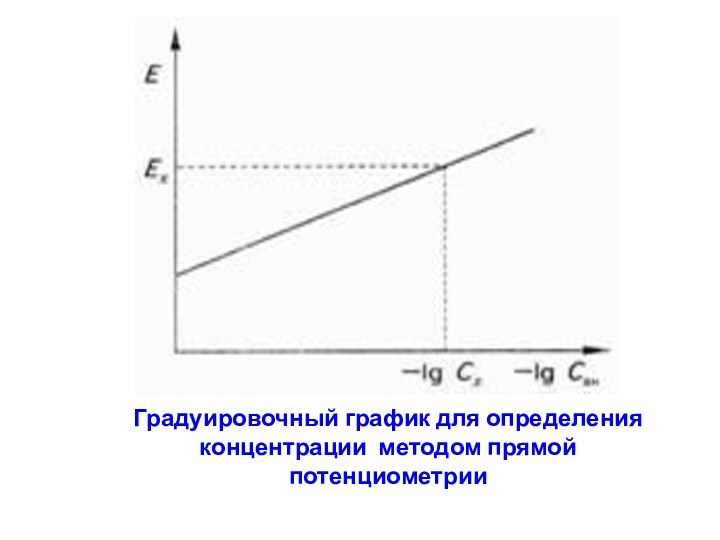
Методы определения концентрации в потенциометрии
Прямая потенциометрия: Измерение потенциал
индикаторного электрода по отношению к электроду сравнения и концентрация
определяемого вещества рассчитывается по уравнению Нернста. На практике более удобным способом является использование градуировочного графика в координатах Е - рС, построенному по серии стандартных растворов
Потенциометрическое титрование
Слайд 18
Градуировочный график для определения концентрации методом прямой потенциометрии
Слайд 19
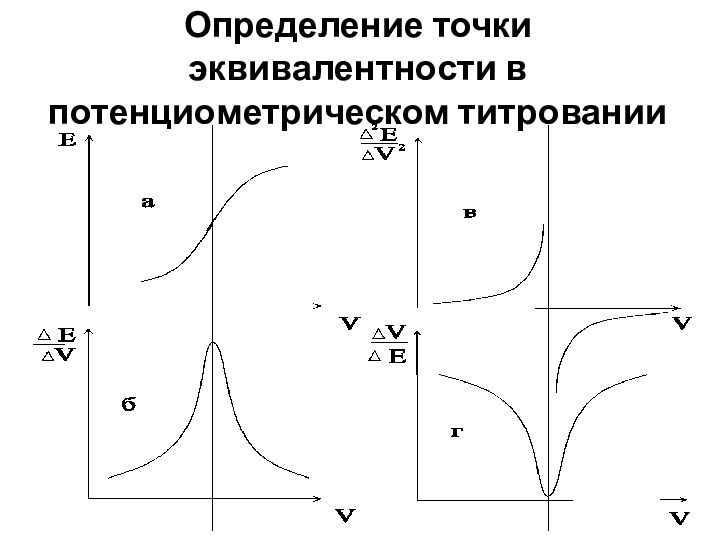
Определение точки эквивалентности в потенциометрическом титровании
Слайд 20
Преимущества метода потенциометрического титрования
Возможность титрования мутных и окрашенных
растворов
Возможность определения смеси веществ
Возможность титрования в неводных растворителях
Возможность автоматизации
анализа, например, титрование до заданного значения рН.
Возможность использования всех типов химических реакций.
Возможность использования различных типов индикаторных электродов, в том числе ионселективных, для повышения избирательности определения
Слайд 21
pH-метры-иономеры
серии "Эксперт-001": слева - переносной, справа - лабораторный
Слайд 22
Общий вид прибора «Эксперт-001»
Слайд 23
Вольтамперометрия
Определение: вольтамперометрия - группа методов электрохимического анализа, основанных
на измерении зависимости силы тока от величины потенциала рабочего
электрода
Слайд 24
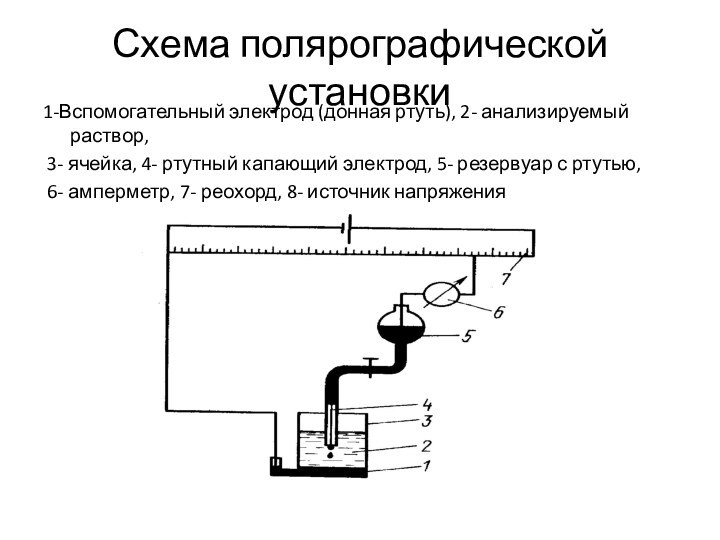
Схема полярографической установки
1-Вспомогательный электрод (донная ртуть), 2- анализируемый
раствор,
3- ячейка, 4- ртутный капающий электрод, 5- резервуар
с ртутью,
6- амперметр, 7- реохорд, 8- источник напряжения
Слайд 25
Ярослав Гейровский (1890-1967)
Лауреат Нобелевской премии 1959 г.
Портрет
Памятник в
Праге
Слайд 27
Первый полярограф
В 1925 году Я.Гейровский и М.
Шиката сконструировали первый полярограф, позволивший автоматически регистрировать поляризационные кривые.
Слайд 28
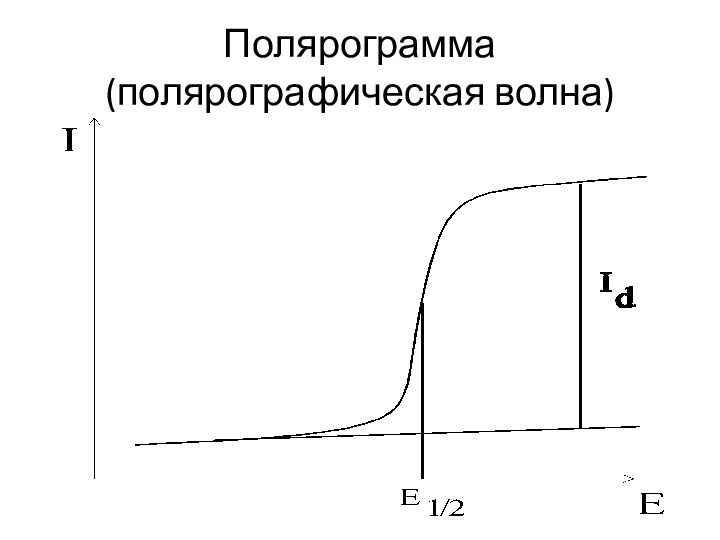
Полярограмма
(полярографическая волна)
Слайд 29
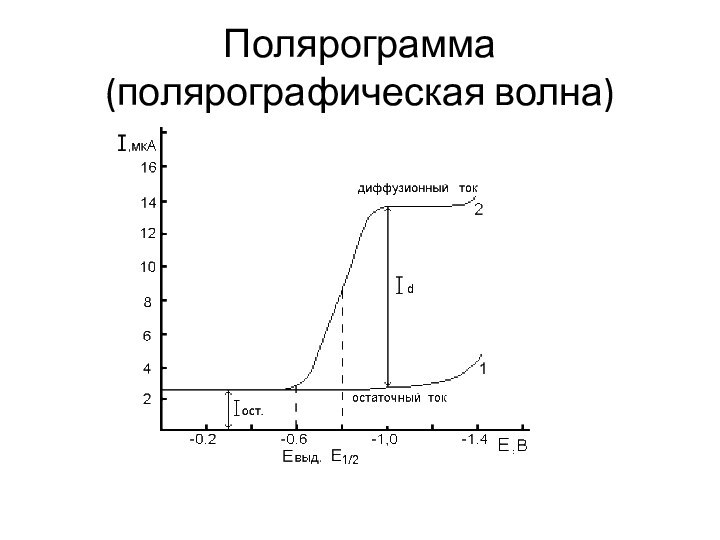
Полярограмма
(полярографическая волна)
Слайд 30
Основные уравнения в полярографии
Уравнение, описывающее полярограмму, было выведено
Гейровским и Ильковичем:
Потенциал полуволны Е1/2 представляет собой потенциал той
точки волны, где ток равен половине своего предельного значения. Потенциал полуволны не зависит от концентрации и является качественной характеристикой вещества. По значению потенциала полуволны в данном фоновом электролите можно провести идентификацию веществ, присутствующих в растворе, то есть провести качественный анализ.
Слайд 31
Основные уравнения в полярографии
Уравнение, связывающее величину предельного тока
с концентрацией, для ртутного капающего электрода вывел Илькович:
Id
= 605nD1/2m2/3t1/6C,
где n - число электронов, участвующих в электрохимической реакции, D - коэффициент диффузии вещества, см2/с, m - масса ртути (мг), вытекающая из капилляра за 1 секунду, t - период капания, сек,
С - концентрация вещества, ммоль/л.
Уравнение Ильковича можно представить в виде
I = K.C, где К - константа пропорциональности, называемая константой Ильковича. На этом уравнении основан количественный анализ.
Слайд 32
Методы определения концентрации в полярографии
Метод градуировочного графика: измеряется
сила диффузионного тока (I) серии стандартных растворов с известной
концентрацией определяемого вещества. Затем строится градуировочный график в координатах I - С, по которому и определяется концентрация неизвестного раствора.
Метод стандартных растворов. Высота волны для неизвестного раствора сравнивается с высотой волны стандартного раствора, концентрация которого известна. Расчет неизвестной концентрации (Сх) проводят по формуле:
Сх=Сст*hх/hст.
3. Метод добавок: измеряется сила диффузионного тока (I) раствора с неизвестной концентрацией и с добавкой известного количества определяемого вещества.
Слайд 33
Возможности и применение полярографии
Определение как качественное, так и
количественное любых электрохимически активных веществ с нижним пределом обнаружения
10-5 моль/л и погрешностью около 2-5%.
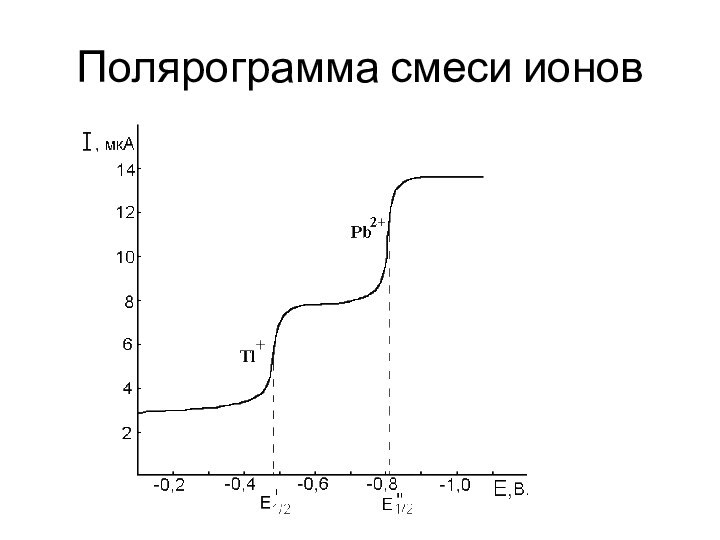
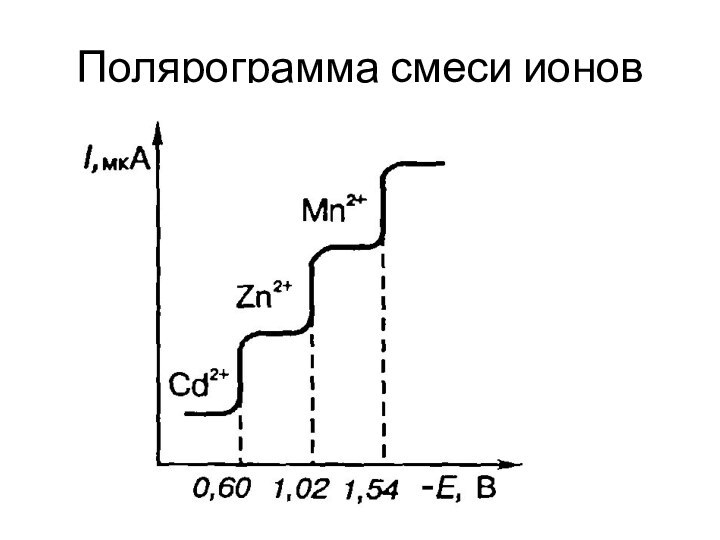
Одновременное определение нескольких компонентов в одном растворе при условии, что их потенциалы полуволн (Е1/2) различаются более чем на 0,2 В.
Возможность определения органических веществ, содержащих следующие функциональные группы: >C=O, >C=C-C=C<, >C=N-, -N=N-, -O-O-,-S-S-, >C=S, -N=O, -NO2, >C=C-C=O и другие, способные к электровосстановлению или электроокислению
Слайд 36
Развитие полярографического метода
Виды полярографии
Дифференциальная полярография
Вольтамперометрия с линейной разверткой
потенциала
Переменнотоковая полярография
Инверсионная вольтамперометрия
Амперометрическое титрование
Аналитические характеристики
Разрешающая способность С
мин.
0,1 В 10-5 моль/л
0,1 В 10-6
0,04 В 5.10-8
0,1 В 10-9-10-11
- -
Слайд 37
Дифференциальная полярография
Основана на электронном дифференцировании I-E кривых и
получении кривой в форме первой производной, на которой максимум
соответствует Е1/2, а высота пика пропорциональна концентрации. При одинаковой с классической полярографией минимально определяемой концентрацией метод характеризуется повышенной разрешающей способностью - разность Е1/2 для раздельной регистрации пиков достаточна 0,1 В.
Слайд 38
Вольтамперометрия с линейной разверткой потенциала
В этом методе увеличение
потенциала рабочего электрода происходит с гораздо большей скоростью, чем
в классической полярографии (1-10 В/с вместо 1-10 мВ/с), в связи с чем для регистрации быстро меняющегося тока используют практически безинерционный прибор - осциллограф. Вид получающихся при этом полярограмм отличается от классических наличием максимума тока, величина которого примерно в 10 раз превышает величину диффузионного тока за счет большего потока вещества к электроду при сокращении времени регистрации кривой. Пропорциональность тока пика концентрации вещества при этом сохраняется, что позволяет определять вещества с концентрацией до 10-6 моль/л при разрешающей способности как в дифференциальном методе - 0,1 В.
Слайд 39
Переменнотоковая полярография
В этом методе на ячейку кроме линейно
возрастающего напряжения подают переменное напряжение синусоидальной или прямоугольной формы
амплитудой 10-50 мВ, что приводит к протеканию через раствор наряду с постоянным током переменного тока. Для регистрации полезного сигнала используют только переменный ток, что позволяет за счет уменьшения емкостной составляющей повысить чувствительность определений до 5*10-8 моль/л, а разрешающая способность при этом возрастает до 0,04 В, так как полярограмма в этом методе имеет вид узких пиков. Потенциал пика практически совпадает с Е1/2, а высота пика также пропорциональна концентрации
Слайд 40
Инверсионная вольтамперометрия
Сущность этого метода заключается в электрохимическом концентрировании
определяемого вещества на поверхности стационарного электрода с последующим растворением
его и регистрации тока растворения. Концентрирование (накопление на электроде) проводят при потенциале электрода, соответствующем потенциалу предельного тока, при непрерывном перемешивании раствора для увеличения скорости подвода вещества к электроду (или используют вращающийся электрод) в течение определенного времени (1-30 мин). Затем прекращают перемешивание и уменьшают потенциал электрода, регистрируя анодную вольтамперограмму в виде пика растворения. Так как время растворения значительно меньше времени накопления, ток растворения гораздо больше тока накопления, что позволяет проводить определение обратимо восстанавливающихся металлов с концентрацией до 10-9, а в отдельных случаях до 10-11 моль/л.
Слайд 41
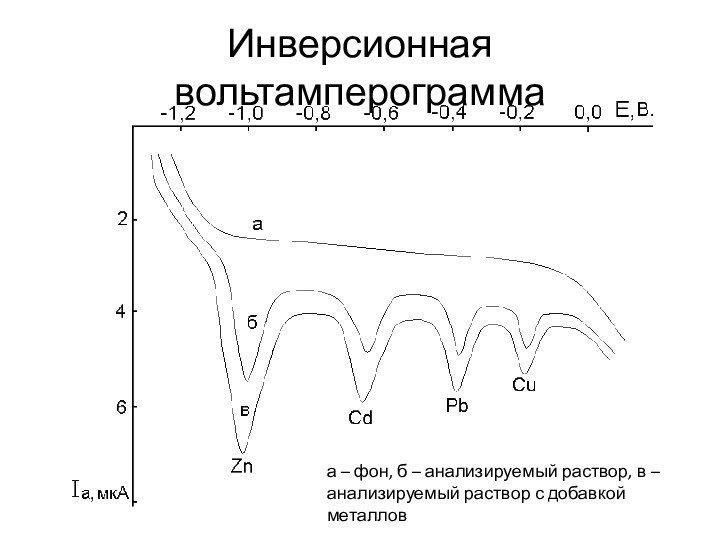
Инверсионная вольтамперограмма
а – фон, б – анализируемый раствор,
в – анализируемый раствор с добавкой металлов
Слайд 42
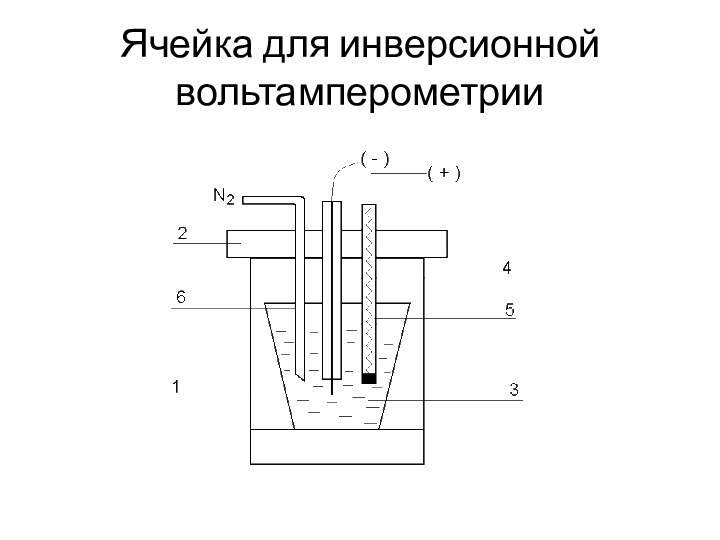
Ячейка для инверсионной вольтамперометрии
Слайд 43
Анализатор тяжёлых металлов АКВ-07МК
Слайд 46
Комплект для полевых измерений тяжелых металлов с микроэлектродом
Слайд 49
Амперометрическое титрование
Этот метод использует изменение величины предельного диффузионного
тока в процессе титрования для определения точки эквивалентности
Слайд 50
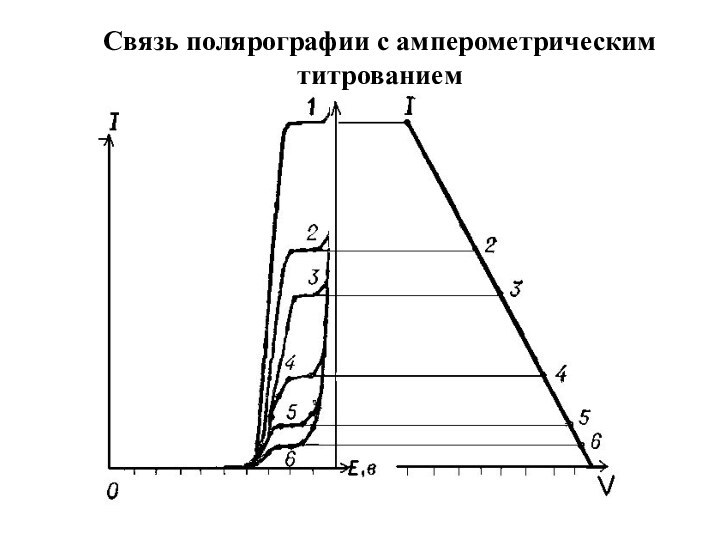
Связь полярографии с амперометрическим титрованием
Слайд 51
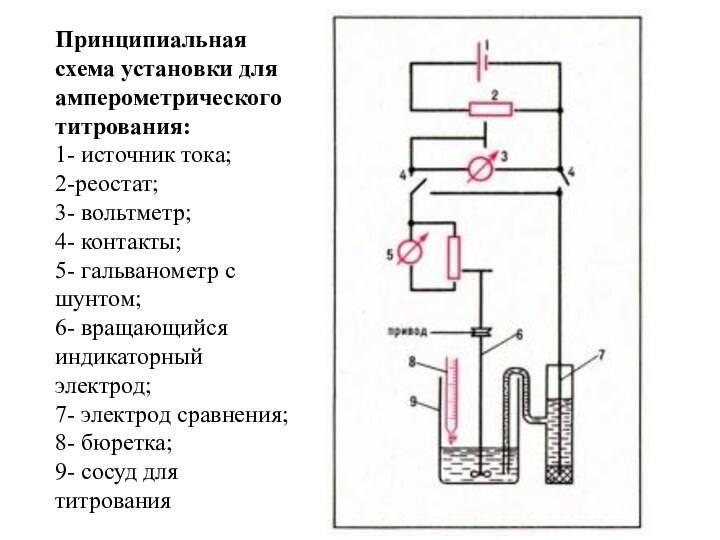
Принципиальная схема установки для амперометрического титрования:
1- источник
тока;
2-реостат;
3- вольтметр;
4- контакты;
5- гальванометр с
шунтом;
6- вращающийся индикаторный электрод;
7- электрод сравнения; 8- бюретка;
9- сосуд для титрования
Слайд 52
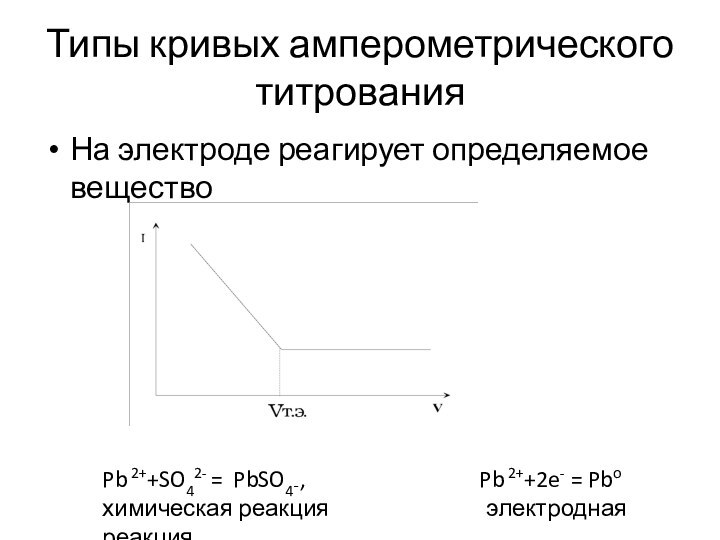
Типы кривых амперометрического титрования
На электроде реагирует определяемое вещество
Pb
2++SO42- = PbSO4¯,
Pb 2++2e- = Pbo
химическая реакция электродная реакция
Слайд 53
Типы кривых амперометрического титрования
На электроде реагирует титрант
3Zn2++2K4[Fe(CN)6]=K2Zn3[Fe(CN)6]2¯+6K+, химическая
реакция,
K4[Fe(CN)6]-e-=K3[Fe(CN)6]+K+ электродная реакция
Слайд 54
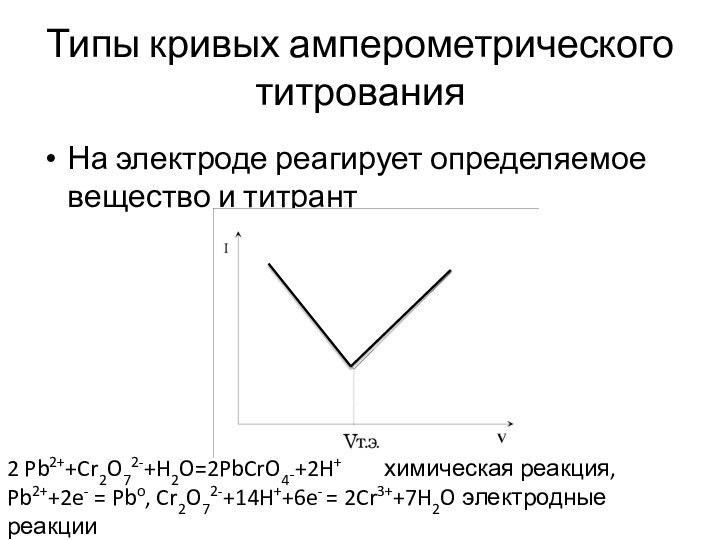
Типы кривых амперометрического титрования
На электроде реагирует определяемое вещество
и титрант
2 Pb2++Cr2O72-+H2O=2PbCrO4¯+2H+ химическая
реакция,
Pb2++2e- = Pbo, Cr2O72-+14H++6e- = 2Cr3++7H2O электродные реакции
Слайд 55
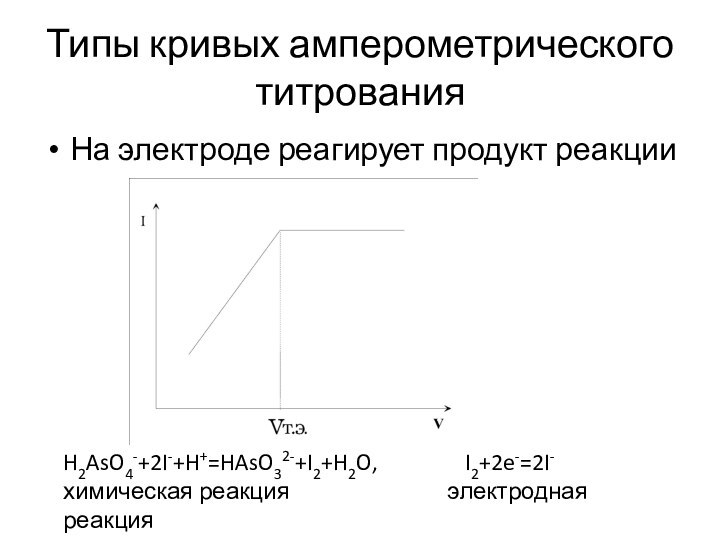
Типы кривых амперометрического титрования
На электроде реагирует продукт реакции
H2AsO4-+2I-+H+=HAsO32-+I2+H2O,
I2+2e-=2I-
химическая реакция
электродная реакция
Слайд 56
Типы кривых амперометрического титрования
На электроде реагирует индикаторное вещество
Al3++6F-=[AlF6]3-,
Fe3++6F-=[FeF6]3-,
Fe3++e-=Fe2+.
химические реакции электродная реакция
Слайд 57
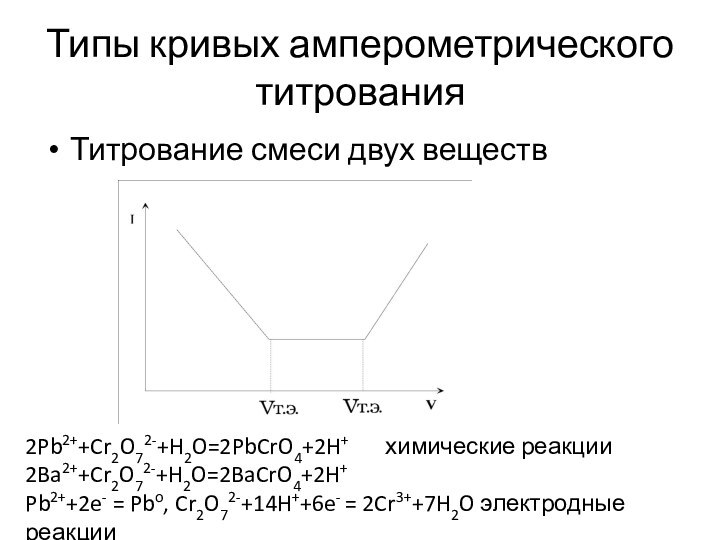
Типы кривых амперометрического титрования
Титрование смеси двух веществ
2Pb2++Cr2O72-+H2O=2PbCrO4+2H+ химические
реакции
2Ba2++Cr2O72-+H2O=2BaCrO4+2H+
Pb2++2e- = Pbo, Cr2O72-+14H++6e- = 2Cr3++7H2O электродные реакции
Слайд 58
Преимущества амперометрического титрования
простота аппаратуры
выбор потенциала наложения для повышения
избирательности метода
возможность использования реакций любого типа
возможность анализа электрохимически неактивных
веществ
возможность применения не только РКЭ, но и твердых электродов
Слайд 59
Кулонометрия
Определение: кулонометрия - электрохимический метод анализа, основанный на
измерении количества электричества, необходимого для количественного электрохимического превращения определяемого
вещества
Слайд 61
Основное уравнение метода
где m - масса вещества,
г;
Q - количество электричества, Кл;
М - молярная масса вещества,
г/моль;
n - число электронов, участвующих в электрохимической реакции, в расчете на одну молекулу вещества;
F - константа Фарадея, 96485 Кл/моль;
I - сила тока, А;
t - время электролиза, с.
Слайд 62
Виды кулонометрии
При контролируемом постоянном потенциале - потенциостатическая кулонометрия.
При
постоянном токе - амперостатическая кулонометрия.
Кулонометрическое титрование
Слайд 63
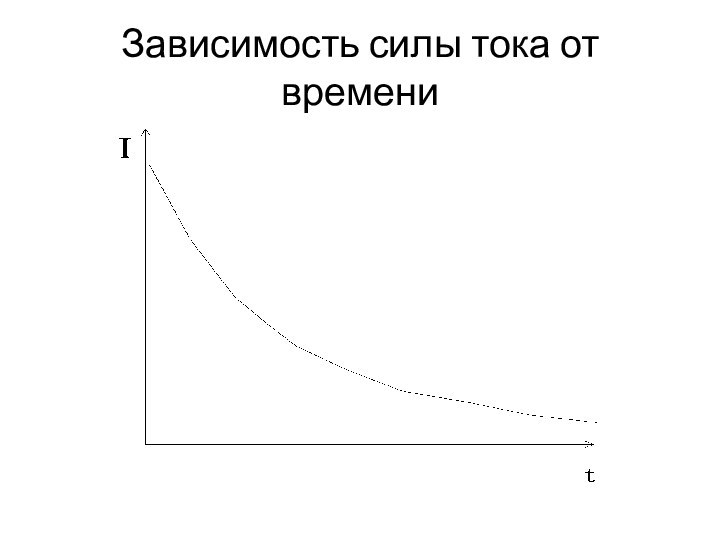
Потенциостатическая кулонометрия
Зависимость силы тока от времени определяется уравнением:
I
= Io.10-kt,
где I - ток в момент времени
t, Io - начальный ток, t - время, k - константа, зависящая от площади электрода, числа электронов, коэффициента диффузии и других факторов
Слайд 64
Зависимость силы тока от времени
Слайд 65
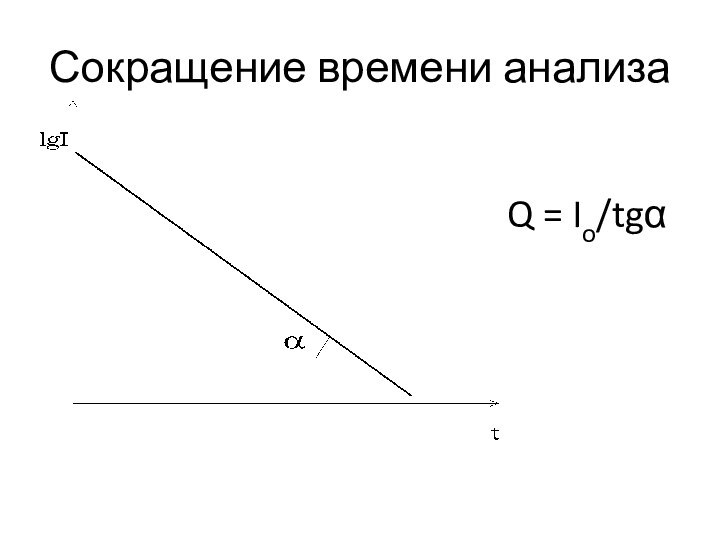
Сокращение времени анализа
Q = Io/tgα
Слайд 66
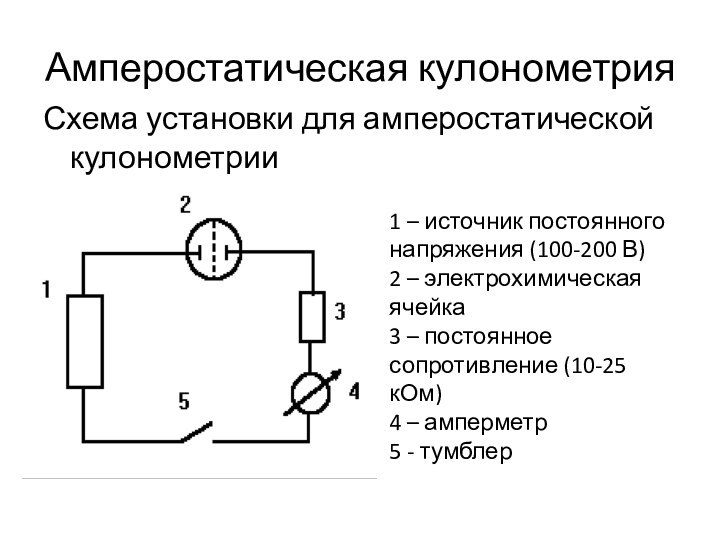
Амперостатическая кулонометрия
Схема установки для амперостатической кулонометрии
1 – источник
постоянного напряжения (100-200 В)
2 – электрохимическая ячейка
3 – постоянное
сопротивление (10-25 кОм)
4 – амперметр
5 - тумблер
Слайд 67
Кулонометрическое титрование
Титрант, используемый в кулонометрическом титровании, получается на
электроде из вспомогательного вещества при прохождении через раствор электрического
тока. Такой способ называется электрогенерированием титранта, а рабочий электрод в этом случае называют генераторным электродом. Образовавшись на электроде, титрант вступает в реакцию с определяемым веществом. Точку эквивалентности определяют с помощью химических индикаторов или одним из инструментальных методов анализа
количество электричества рассчитывают по простой формуле: Q = I.t.
Слайд 68
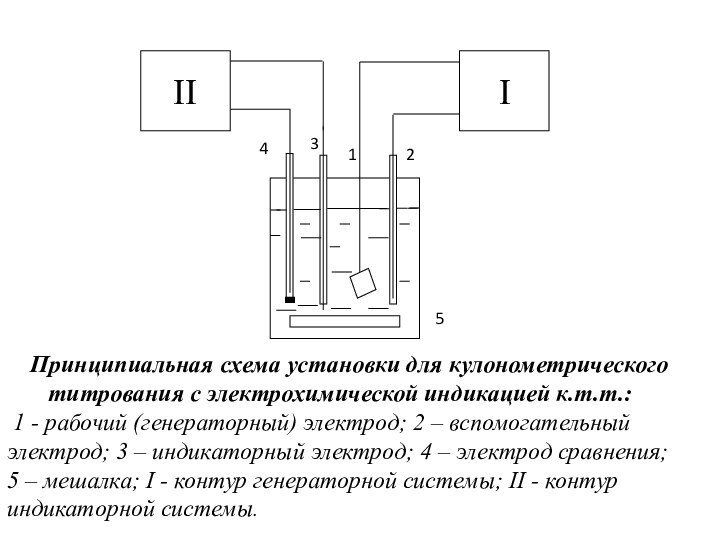
Принципиальная схема
установки для кулонометрического титрования с электрохимической индикацией к.т.т.:
1
- рабочий (генераторный) электрод; 2 – вспомогательный электрод; 3 – индикаторный электрод; 4 – электрод сравнения; 5 – мешалка; I - контур генераторной системы; II - контур индикаторной системы.
4
3
1
2
5
Слайд 69
Примеры кулонометрического титрования
Определение тиосульфата натрия электрогенерированным йодом, когда
на электроде (аноде) протекает электрохимическая реакция: 2I- - 2e-
= I2,
а в растворе химическая:
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
Точку эквивалентности легко определить по появлению синей окраски, образованной избытком иода с крахмалом.
Слайд 70
Примеры кулонометрического титрования
Определение кислот титрованием электрогенерированными ионами ОН-
на
катоде: 2Н3О+ + 2е– = Н2+ 2Н2О;
2Н2О +
2е– = Н2 + 2ОН–,
в растворе: ОН– + Н3О+ = 2Н2О
После завершения химической реакции избыток ионов ОН- создаст в растворе щелочную среду, что можно обнаружить с помощью кислотно-основного индикатора (фенолфталеина) или потенциометрически со стеклянным индикаторным электродом.
Слайд 71
Преимущества кулонометрического титрования
Высокая точность (до 0,01%), обусловленная высокой
точностью измерения тока и времени
Высокая чувствительность - минимально определяемые
концентрации до 10-6 моль/л
Возможность использования малоустойчивых титрантов, не применяемых в обычном титровании из-за нестабильности стандартных растворов, таких как Ag(II), Cr(II), Cu(I), Sn(II), Fe(II)
Возможность автоматизации анализа
Не требуется стандартных веществ и стандартизации титранта, так как стандартом является физическая константа F - константа Фарадея
Возможность использования любых типов химических реакций
Слайд 73
Кондуктометрия
Определение: Кондуктометрический метод анализа основан на измерении электрической
проводимости растворов, зависящей от концентрации электролита
Слайд 74
Основные уравнения метода
Электрическая проводимость L, См (Сименс): L=1/R,
где R -сопротивление раствора, Ом.
Сопротивление раствора R= r*l/S, где
l - расстояние между электродами, S - площадь электродов, r - удельное сопротивление.
Удельная электрическая проводимость æ=1/r
Эквивалентная электрическая проводимость l= æ*1000/С, где С - концентрация, моль/л.
Подвижность ионов U- скорость их движения (v) при напряженности электрического поля 1 В/см, умноженная на константу Фарадея F: U=v*F.
Проводимость раствора L=k*(S/l)*C*U, при S и l постоянных, что справедливо для определенной ячейки, имеем: L=K*C*U.
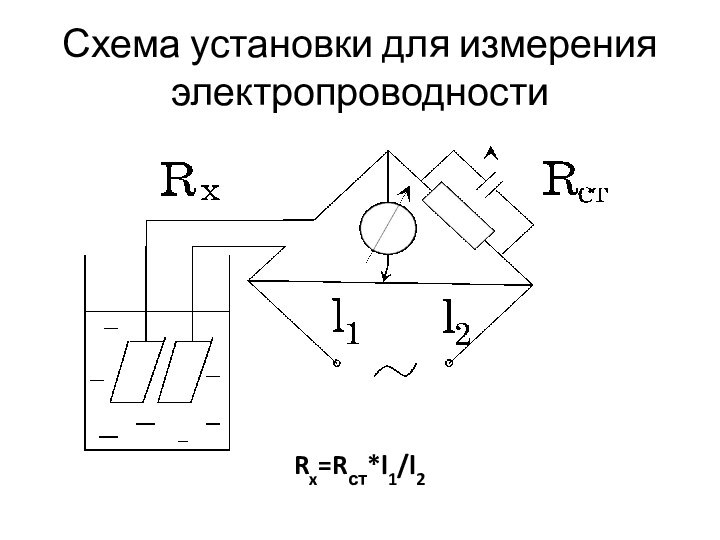
Слайд 75
Схема установки для измерения электропроводности
Rx=Rст*l1/l2
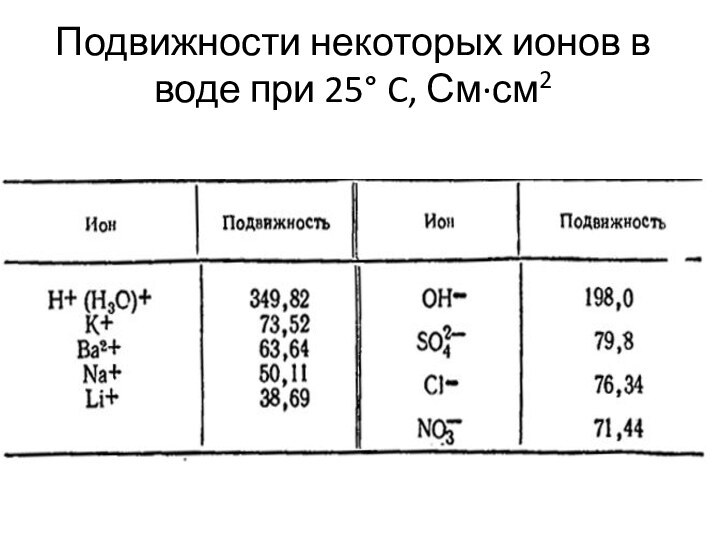
Слайд 76
Подвижности некоторых ионов в воде при 25° C,
См·см2
Слайд 77
Подвижности ионов водорода и гидроксила в водных растворах
аномально велики по сравнению с подвижностями других ионов. Это
обусловлено особым механизмом переноса электрического заряда ионами Н+(Н3О+) и ОН-. Так, в кислых растворах при наложении поля положительный заряд переходит от иона гидроксония вместе с атомом водорода к ближайшей молекуле воды, которая становится ионом Н3О+. Этот ион, в свою очередь, передает заряд соседней молекуле воды и т.д. Таким образом, за короткое время положительный заряд переносится на значительное расстояние. Описанный механизм может быть пояснен схемой:
Благодаря такому эстафетному механизму переноса протонов ионы гидроксония в действительности не двигаются через раствор и перенос тока осуществляется путем перераспределения электронов в молекулах воды.
Слайд 78
Методы определения концентрации веществ
Прямая кондуктометрия. По градуировочному графику
в координатах L - C. Метод прямой кондуктометрии не
селективен, любые посторонние электролиты будут мешать определению. При проведении измерения необходимо термостатирование раствора. Применяется для оценки общего содержания электролитов в растворе и анализе растворов индивидуальных веществ
Кондуктометрическое титрование. Основано на определении точки эквивалентности по изменению электрической проводимости раствора в процессе титрования, что связано с различной подвижностью ионов.
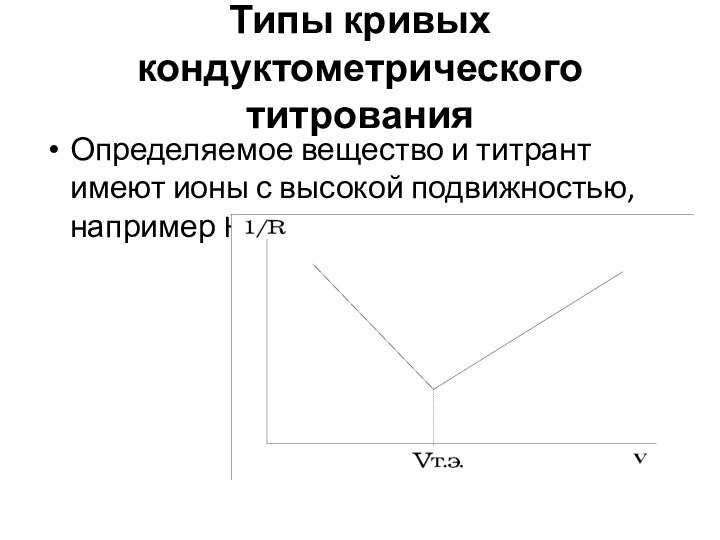
Слайд 79
Типы кривых кондуктометрического титрования
Определяемое вещество и титрант имеют
ионы с высокой подвижностью, например HCl и NaOH
Слайд 80
Типы кривых кондуктометрического титрования
Определяемое вещество имеют ионы с
низкой подвижностью, а титрант с высокой, например CaCl2+NaOH
Слайд 81
Типы кривых кондуктометрического титрования
Определяемое вещество имеет ионы с
высокой подвижностью, а титрант с низкой, например HCl+NaHCO3
Слайд 82
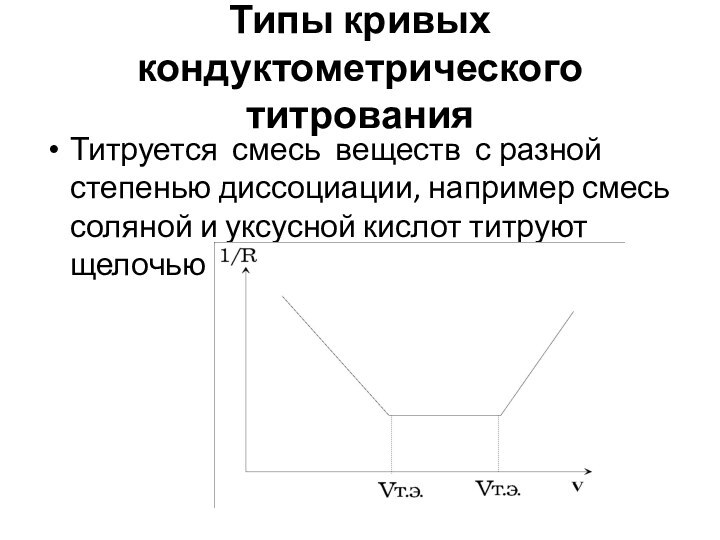
Типы кривых кондуктометрического титрования
Титруется смесь веществ с разной
степенью диссоциации, например смесь соляной и уксусной кислот титруют
щелочью
Слайд 83
Возможности и преимущества метода кондуктометрического титрования
Возможность титрования окрашенных
и мутных растворов.
Возможность анализа смеси веществ.
Возможность использования всех типов
химических реакций - кислотно-основных, осаждения, комплексообразования, окислительно-восстановительных.
Возможность автоматизации анализа.
Возможность анализа разбавленных растворов с концентрацией до 10-4 М.





































![Электрохимические методы анализа Типы кривых амперометрического титрованияНа электроде реагирует титрант3Zn2++2K4[Fe(CN)6]=K2Zn3[Fe(CN)6]2¯+6K+, химическая реакция, K4[Fe(CN)6]-e-=K3[Fe(CN)6]+K+ электродная реакция](/img/tmb/14/1383141/7ba1047d401c9eaf2de8a6ef9f567eff-720x.jpg)
![Электрохимические методы анализа Типы кривых амперометрического титрованияНа электроде реагирует индикаторное веществоAl3++6F-=[AlF6]3-, Fe3++6F-=[FeF6]3-,](/img/tmb/14/1383141/4942f25818dcab905d0608150b600121-720x.jpg)