- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Соединения фосфора
Содержание
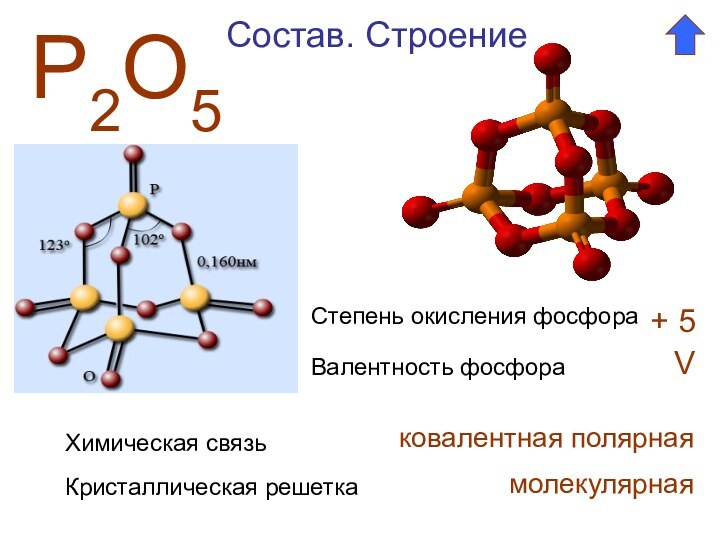
- 2. Р2О5Степень окисления фосфора + 5Валентность фосфора VСостав. СтроениеХимическая связьковалентная полярнаяКристаллическая решеткамолекулярная
- 3. Физические свойства оксида фосфора (V)Оксид фосфора (V),
- 4. Химические свойства оксида фосфора (V)К какой группе
- 5. P2O5 + H2O = H3PO4ортофосфорная кислотаP2O5 +
- 6. Получение фосфорной кислоты
- 7. Состав. Строение. СвойстваН3РО4Степень окисления фосфора +
- 8. Фосфорная кислота (H3РO4). КлассификацияФосфорная кислота по:наличию кислорода:основности:растворимости в воде:летучести:степени электролитической диссоциации:стабильности:кислородсодержащаятрехосновнаярастворимаянелетучаясредней силы стабильная
- 9. Химические свойстваФосфорная кислота проявляет все свойства кислотОпишите
- 10. Взаимодействие фосфорной кислоты со щелочами:H3PO4 + 3NaOH
- 11. Взаимодействие фосфорной кислоты с основными оксидами:2H3PO4 +
- 12. Взаимодействие фосфорной кислоты с солями:2H3PO4 + 3Na2CO3
- 13. Качественная реакция на фосфат-ионЛабораторный опыт:Налейте в пробирку
- 14. Взаимодействие фосфорной кислоты с металламиФосфорная кислота
- 15. Соли фосфорной кислотыNa3PO4Ca3(PO4)2Na2HPO4CaHPO4NaH2PO4Ca(H2PO4)2фосфатыгидрофосфатыдигидрофосфатысредние соликислые солиPPMPННННРО43–НННNH4+Be2+Li+K+Na+Mg2+Ca2+Ba2+Al3+Zn2+Ag+
- 16. Применение фосфорной кислоты и фосфатов1235476В пищевой промышленности
- 17. Скачать презентацию
- 18. Похожие презентации














Слайд 3
Физические свойства оксида фосфора (V)
Оксид фосфора (V), или
фосфорный ангидрид, Р2О5 – белый рыхлый порошок. Это очень
гигроскопичное вещество, которое эффективно используется для осушения газов.
Слайд 4
Химические свойства оксида фосфора (V)
К какой группе оксидов
относится оксид фосфора (V) ?
Оксид фосфора (V) кислотный
оксидКакие свойства характерны для кислотных оксидов?
Взаимодействие с водой, основными оксидами, основаниями.
Составьте уравнения реакций оксида фосфора (V) c
водой,
оксидом кальция,
гидроксидом натрия.
Реакции обмена рассмотрите с т. зр. ТЭД
Слайд 5
P2O5 + H2O = H3PO4
ортофосфорная кислота
P2O5 + СaO
= Ca3(PO4)2
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
P2O5 +
6Na+ + 6OH– = 6Na++ 2PO43– + 3H2OP2O5 + 6OH– = PO43– + 3H2O
опыт
Слайд 7
Состав. Строение. Свойства
Н3РО4
Степень окисления фосфора
+ 5
Валентность
фосфора
V
Химическая связь
ковалентная полярная
Н3РО4 – белые прозрачные кристаллы, не
ядовита, с водой смешивается в любых соотношениях. t плавл.= 42Cº, плавится без разложения. Прокаливание приводит к частичной потере воды: Н3РО4 = НРО3 + Н2О
Слайд 8
Фосфорная кислота (H3РO4). Классификация
Фосфорная кислота по:
наличию кислорода:
основности:
растворимости
в воде:
летучести:
степени электролитической диссоциации:
стабильности:
кислородсодержащая
трехосновная
растворимая
нелетучая
средней силы
стабильная
Слайд 9
Химические свойства
Фосфорная кислота проявляет все свойства кислот
Опишите химические
свойства фосфорной кислоты
1) со щелочами: NaOH, KOH
2) с основными
оксидами: Li2O, Na2O3) с солями: Na2CO3
Лабораторный опыт
«Качественная реакция на фосфат-ион»
4) с металлами
Слайд 10
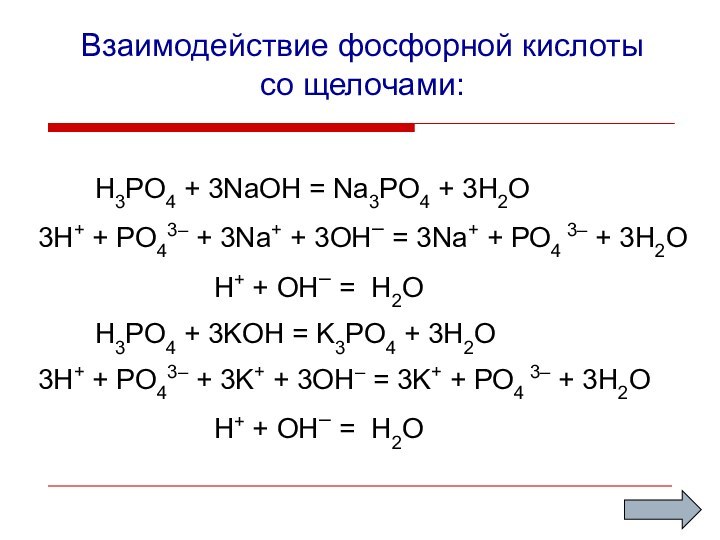
Взаимодействие фосфорной кислоты
со щелочами:
H3PO4 + 3NaOH =
Na3PO4 + 3H2O
3H+ + PO43– + 3Na+ + 3OH–
= 3Na+ + PO4 3– + 3H2OH+ + OH– = H2O
H3PO4 + 3KOH = K3PO4 + 3H2O
3H+ + PO43– + 3K+ + 3OH– = 3K+ + PO4 3– + 3H2O
H+ + OH– = H2O
Слайд 11
Взаимодействие фосфорной кислоты
с основными оксидами:
2H3PO4 + 3Na2O
= 2Na3PO4 + 3H2O
6H+ + 2PO43– + 3Na2O =
6Na+ + 2PO4 3– + 3H2O6H+ + 3Na2O = 6Na+ + 3H2O
2H3PO4 + 3Li2O = 2Li3PO4 + 3H2O
6H+ + 2PO43– + 3Li2O = 6Li+ + 2PO4 3– + 3H2O
6H+ + 3Li2O = 6Li+ + 3H2O
Слайд 12
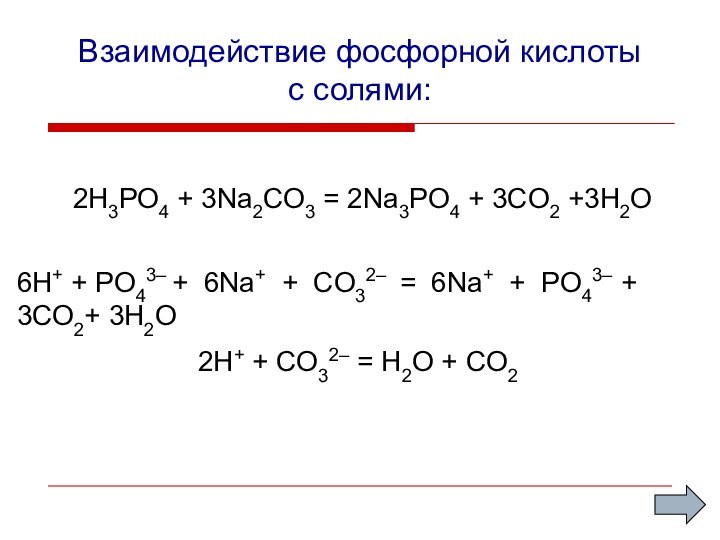
Взаимодействие фосфорной кислоты
с солями:
2H3PO4 + 3Na2CO3 =
2Na3PO4 + 3CO2 +3H2O
2H+ + CO32– = H2O
+ CO26Н+ + PО43– + 6Nа+ + CO32– = 6Nа+ + PO43– + 3CO2+ 3H2O
Слайд 13
Качественная реакция на фосфат-ион
Лабораторный опыт:
Налейте в пробирку 1
мл раствора фосфата натрия и добавьте к нему такой
же объем нитрата серебра. Что происходит? Напишите уравнение реакции.Na3PO4 + 3AgNO3 = Ag3PO4 + 3NaNO3
Ag+ + PO43– = Ag3PO4
Слайд 14
Взаимодействие фосфорной кислоты
с металлами
Фосфорная кислота может
быть слабым окислителем только за счет ионов Н+ .
При взаимодействии с активными металлами выделяется водород.Составьте уравнение реакции фосфорной кислоты с магнием.
2H3PO4 + 3Mg = Mg3(PO4)2 + 3H2
6H3PO4 + 2Al = 2Al(H2PO4)3 + 3H2
Слайд 15
Соли фосфорной кислоты
Na3PO4
Ca3(PO4)2
Na2HPO4
CaHPO4
NaH2PO4
Ca(H2PO4)2
фосфаты
гидрофосфаты
дигидрофосфаты
средние соли
кислые соли
P
P
M
P
Н
Н
Н
Н
РО43–
Н
Н
Н
NH4+
Be2+
Li+
K+
Na+
Mg2+
Ca2+
Ba2+
Al3+
Zn2+
Ag+
Слайд 16
Применение фосфорной кислоты и фосфатов
1
2
3
5
4
7
6
В пищевой промышленности как
добавку к
безалкогольным напиткам
Фосфаты кальция входят в состав зубных
паст, материалов для пломбирования зубов
Фосфаты кальция входят в состав витаминных
добавок для домашних животных
Фосфаты натрия находят применение для защиты
железных покрытий от коррозии, они входят в
состав моющих и чистящих средств.
Фосфаты натрия входят в состав огнеупорных
красок.
Производство минеральных удобрений
Фосфорная кислота является
катализатором в органическом синтезе