- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Растворы электролитов
Содержание
- 2. Растворы электролитовЭлектролиты – вещества с ионной проводимостью.Это
- 3. II закон Рауля∆Tкип =iEm∆Tзам=iKmЗакон Вант-Гоффа∆Pосм=icRT
- 4. i – поправочный коэффициент изотонический i –
- 5. Теория электролитической диссоциации АррениусаРаспад молекул электролитов на
- 6. Количественная характеристика процесса диссоциации выражается степенью электролитической диссоциации – α.
- 7. Современная теория электролитической диссоциации: Гидратация─ +─ +─ +─ +─ +─ +─ +─ +─+2) Ионизация
- 8. 3) Диссоциация─ +─ +─ +─ +─ +─
- 9. Способность гидратироваться зависит:- от природы ионов от
- 10. По степени диссоциации:Сильные электролиты – α >
- 11. Растворы слабых электролитовЧем больше Кд тем сильнее диссоциирует электролит.NH4OH = NH4+ + OH-
- 12. Закон разбавления Освальдаα
- 13. Растворы сильных электролитовNaCl i≈2NaCl → Na+ +
- 14. 1907 Льюис → активность (а) → эффективная
- 15. Коэффициент активности зависит от ионной силы раствора
- 16. (H2PO4)- ↔ H+ + (HPO4)2-(HPO4)2- ↔ H+ + PO43-K1 > K2 > K3
- 17. Ионное произведение воды.pH – растворов. Н2О ↔
- 18. Нейтральный раствор[H+] = 10-7 г-ион/л [OH-] =
- 19. В нейтральной среде:[H+] = 10-7-Lg[10-7] = 7
- 20. Пример 1:[OH-] = 10-11pH = ?[H+][OH-] =
- 21. Скачать презентацию
- 22. Похожие презентации
Растворы электролитовЭлектролиты – вещества с ионной проводимостью.Это растворы солей, кислоты, оснований, расплавы солей.I – закон Рауля для электролитов:















![Растворы электролитов Ионное произведение воды.pH – растворов. Н2О ↔ H+ + ОН-Kводы = [H+][OH-]](/img/tmb/15/1463519/51d4fac9077c72f07b84d23465295968-720x.jpg)
![Растворы электролитов Нейтральный раствор[H+] = 10-7 г-ион/л [OH-] = 10-7 г-ион/лКислый раствор[H+] > 10-7](/img/tmb/15/1463519/19138ea6da408674f216e3fa1d95c995-720x.jpg)
![Растворы электролитов В нейтральной среде:[H+] = 10-7-Lg[10-7] = 7 → pH = 7 В](/img/tmb/15/1463519/a68dd1d7e2894f54da0b8707240cbb9a-720x.jpg)
![Растворы электролитов Пример 1:[OH-] = 10-11pH = ?[H+][OH-] = 10-14x⋅10-11 = 10-14[H+] = 10-3](/img/tmb/15/1463519/cd34db3e6aac1778a28b13e39a31126a-720x.jpg)
![Растворы электролитов Пример 2:pH = 2[OH-] = ?[H+] = 10-210-2 ⋅x = 10-14[OH-] = 10-12 г-ион/л](/img/tmb/15/1463519/17a155b2cfb06d6958cb4e158228cdb1-720x.jpg)
Слайд 2
Растворы электролитов
Электролиты – вещества с ионной проводимостью.
Это растворы
солей, кислоты, оснований, расплавы солей.
электролитов:
Слайд 4
i – поправочный коэффициент изотонический
i – зависит
от:
природы раствора
концентрации раствора
i>1 для растворов солей,
кислот и оснований
Слайд 5
Теория электролитической диссоциации Аррениуса
Распад молекул электролитов на ионы
в среде растворителя под действием молекул растворителя.
NaCl →
Количество частиц
при диссоциации увеличивается.Cl-
Na+
+
Слайд 6 Количественная характеристика процесса диссоциации выражается степенью электролитической диссоциации
– α.
Слайд 7
Современная теория электролитической диссоциации:
Гидратация
─ +
─ +
─ +
─
+
─ +
─ +
─ +
─ +
─
+
2) Ионизация
Слайд 8
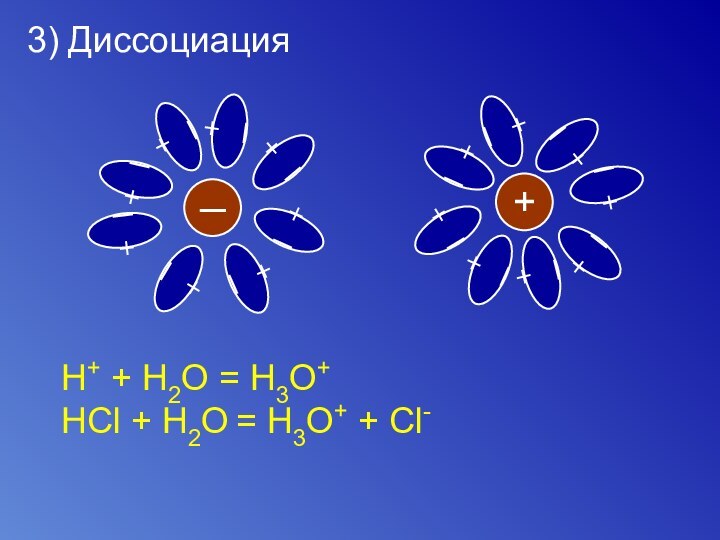
3) Диссоциация
─ +
─ +
─ +
─ +
─ +
─ +
─
+
─ +
─
+
─ +
─ +
─ +
─ +
─ +
─ +
─ +
─
+H+ + H2O = H3O+
HCl + H2O = H3O+ + Cl-
Слайд 9
Способность гидратироваться зависит:
- от природы ионов
от заряда
иона
от размера иона
от строения электронной оболочки
Al3+ >
Cr3+ > Zn2+ > Na+Энтальпия гидратации ионов:
∆Hгид.соли = ∆H+гид+ ∆Н-гид
∆S>0 Гидратация сопровождается значительным разрушением структуры
∆S<0 если структура растворителя упорядочивается
Слайд 10
По степени диссоциации:
Сильные электролиты – α > 50%
все соли, неорганические кислоты, гидроксиды щёлочных и щелочноземельных металлов:
HCl, H2SO4, HNO3Слабые электролиты – α < 50% Н2S, H2SiO3, H2CO3, CH3COOH, гидрооксиды d – элементов (нерастворимые вещества), NH4OH.
Слайд 11
Растворы слабых электролитов
Чем больше Кд тем сильнее диссоциирует
электролит.
NH4OH = NH4+ + OH-
Слайд 12
Закон разбавления Освальда
α
С – разбавлением раствора
степень диссоциации увеличивается.с – молярная концентрация электролита
сα – концентрация каждого из ионов
с(1-α) – концентрация недиссоциирующих частиц.
Слайд 13
Растворы сильных электролитов
NaCl i≈2
NaCl → Na+ + Cl-
от
наличия одноимённых ионов
СН3COOH ↔ H+ + CH3COO-
СН3COONa → CH3COO- + Na+- от температуры, увеличение t° вызывает ассоциацию ионов.
Слайд 14 1907 Льюис → активность (а) → эффективная концентрация
ионов.
а = f·c; f = 1 a
= cАктивность отражает:
Неполную диссоциацию молекул
Взаимное притяжение разноименных ионов
Влияние гидратации ионов
Взаимодействия между молекулами растворителя.
Слайд 15
Коэффициент активности зависит от ионной силы раствора (J).
А
– коэффициент пропор., зависит от вида растворителя.
Кислоты – диссоциируют
на катионы H+ и анион кислотного остаткаHCl → H+ + Cl-
Н3РО4 ↔ [H+][H2PO4]-
Слайд 17
Ионное произведение воды.
pH – растворов.
Н2О ↔ H+
+ ОН-
Kводы = [H+][OH-] = 1,1⋅10-14 г-ион/л –
увеличивается с ростом температуры.K´воды = [H+][OH-] – ионное произведение воды
[H+][OH-] = 1⋅10-14 тогда
[H+] = [OH-] = = 10-7 г-ион/л
Слайд 18
Нейтральный раствор
[H+] = 10-7 г-ион/л
[OH-] = 10-7
г-ион/л
Кислый раствор
[H+] > 10-7 г-ион/л
[OH-] < 10-7 г-ион/л
Щелочной раствор
[H+]
< 10-7 г-ион/л[OH-] > 10-7 г-ион/л
Водородный показатель
-Lg[H+] = pH
Слайд 19
В нейтральной среде:
[H+] = 10-7
-Lg[10-7] = 7 →
pH = 7
В кислой среде:
[H+] = 10-5
-Lg[10-5] =
5 → pH = 5 pH < 7 ([Н+] < 10-7)
В щелочной среде:
[H+] = 10-9
-Lg[10-9] = 9 → pH = 9
pH > 7 ([Н+] > 10-7)





























