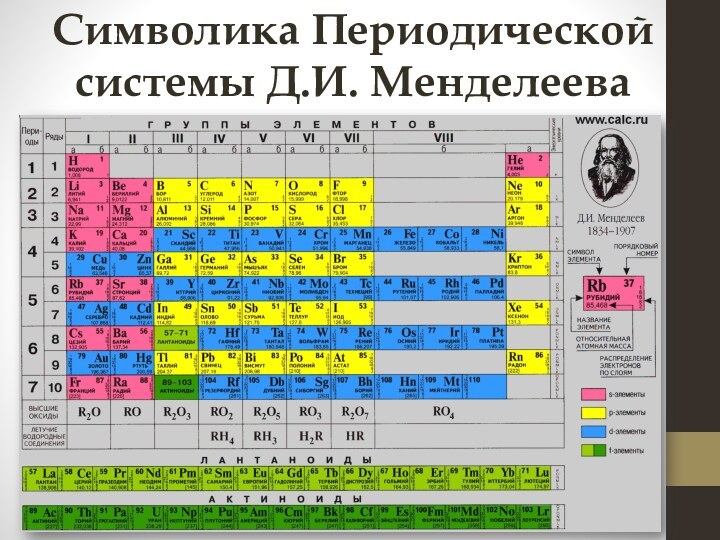
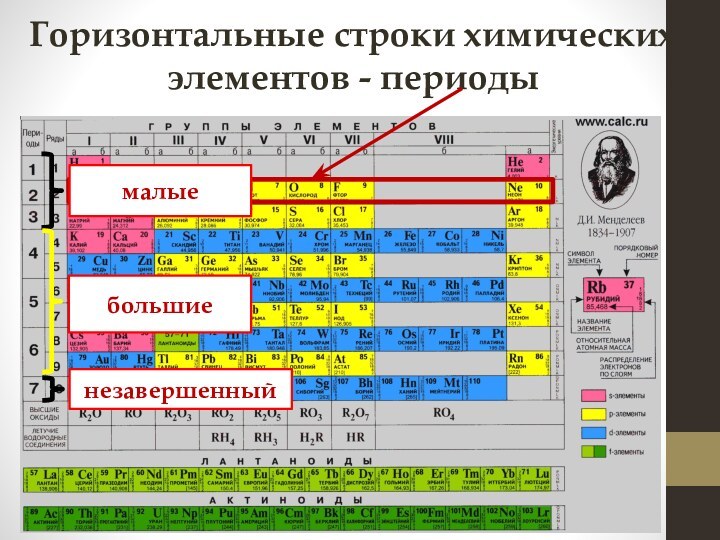
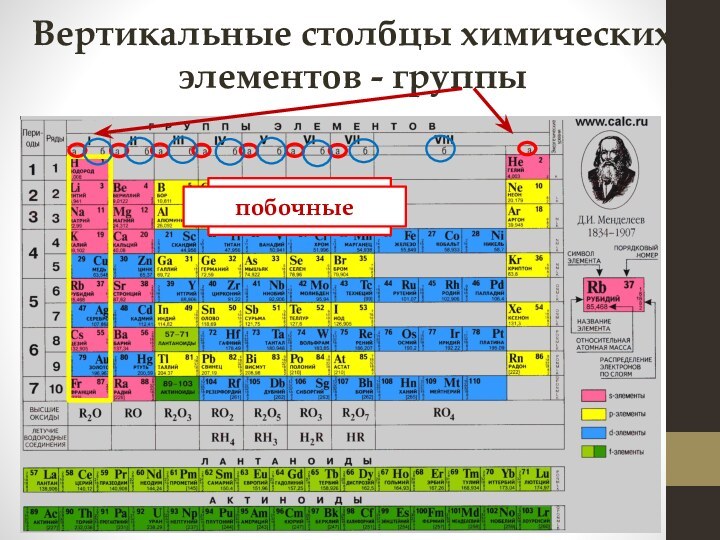
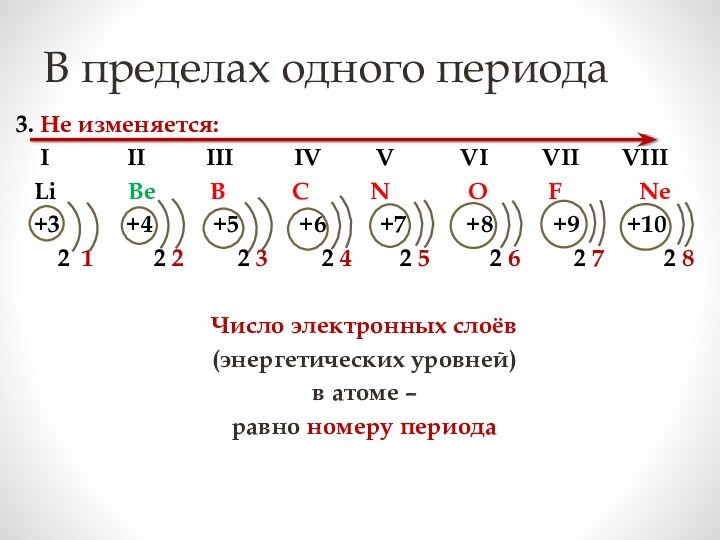
электронных слоев
в электронной оболочке атома равно номеру периода,
в котором расположен элемент
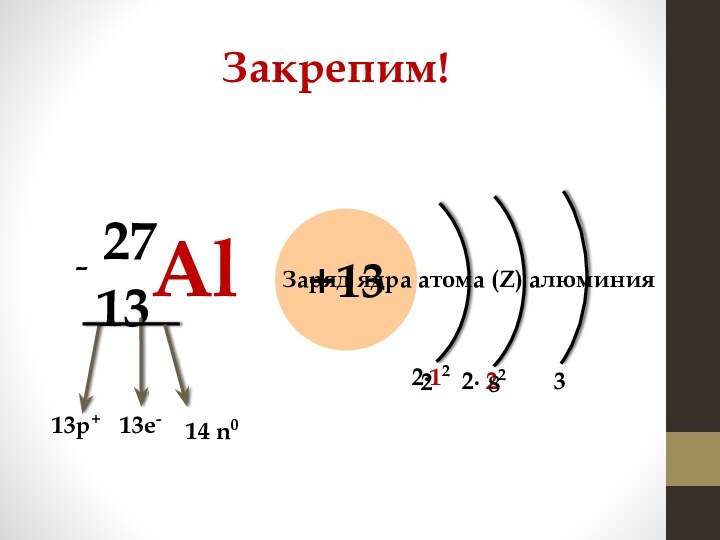
Натрий: порядковый номер 11
(записывается в нижнем левом углу
рядом с символом химического элемента)
Относительная атомная масса
(округленное до целого числа значение)
записывается в верхнем левом углу над
порядковым номером
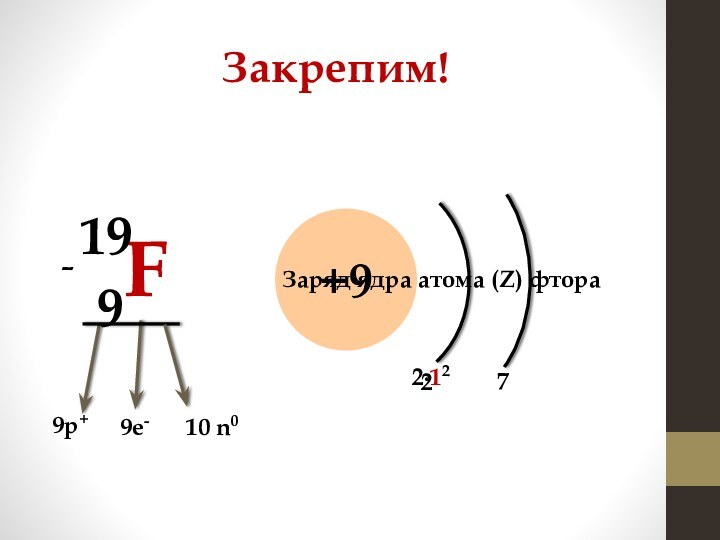
11р+
11е-
Количество нейтронов вычисляется
по формуле: N(n0) = Ar – N(p+)
-
12 n0
Заряд ядра атома (Z) натрия
Число электронов на внешнем уровне для элементов главных подгрупп равно номеру группы, в которой расположен элемент
1
Максимальное число электронов
на уровне вычисляется по формуле:
2n2
2∙12
2
2∙ 22
8