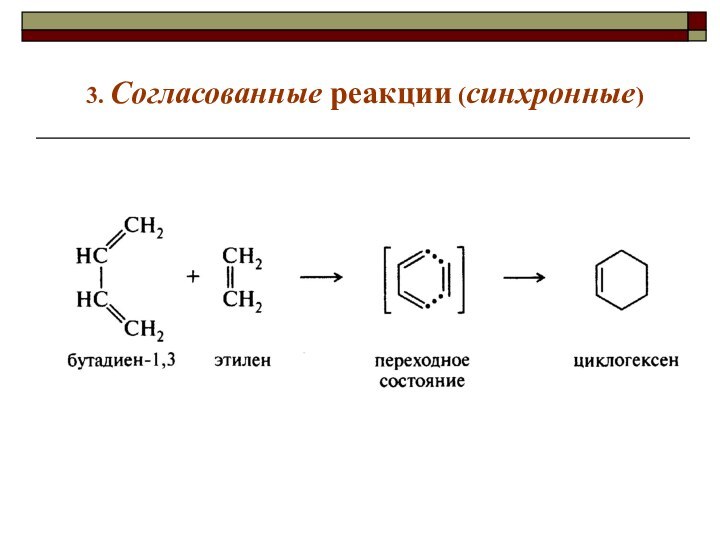
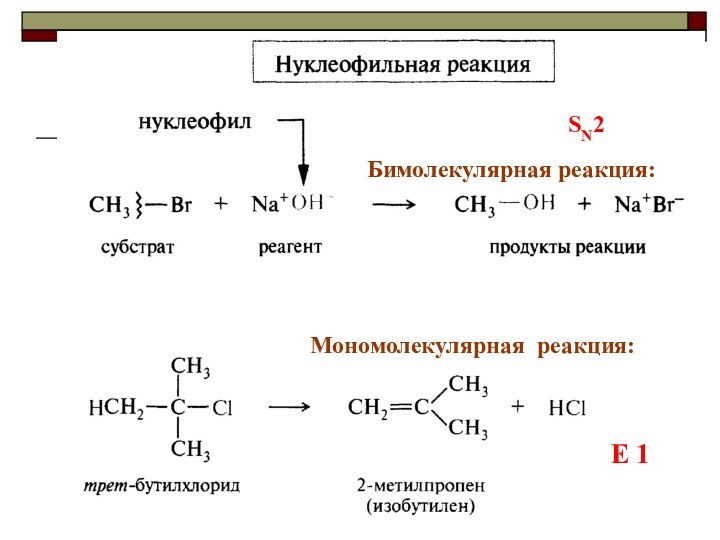
реакции делят на
1)
реакции замещения , S , (substitution замещение)CH4 + Cl2 CH3Cl + HCl вытеснен один атом;
һν
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть









































































CH4 + Cl2 CH3Cl + HCl вытеснен один атом;
һν
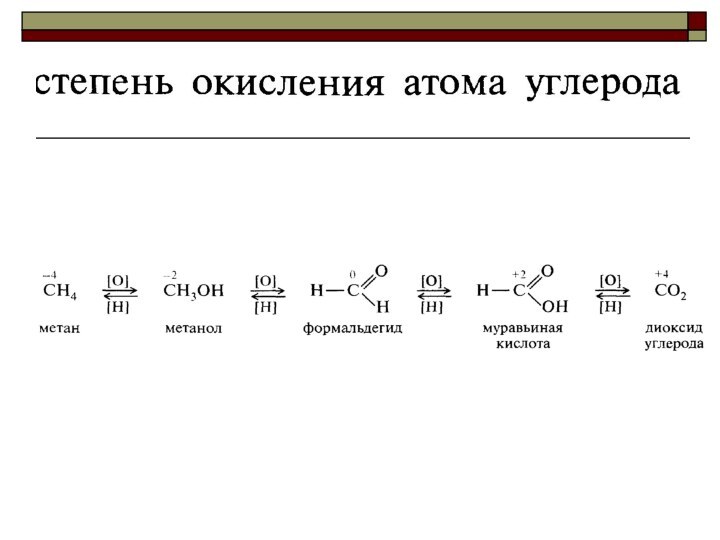
Oкислитель всегда принимает (отнимает!) электроны,
а восстановитель - отдаёт их!
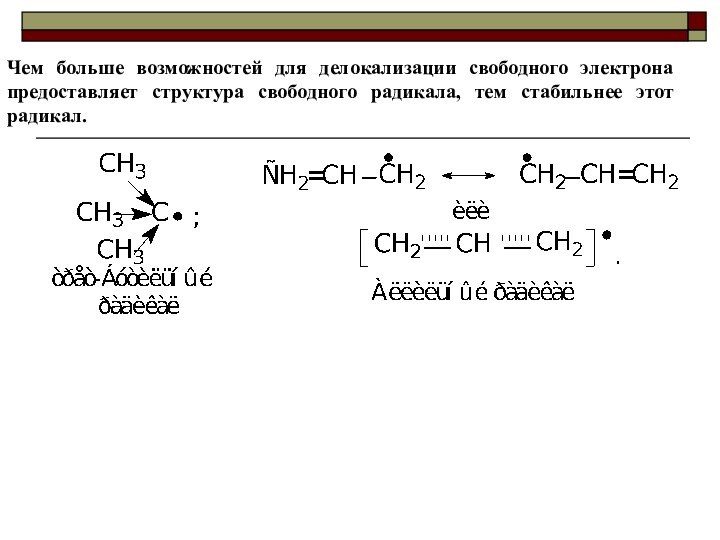
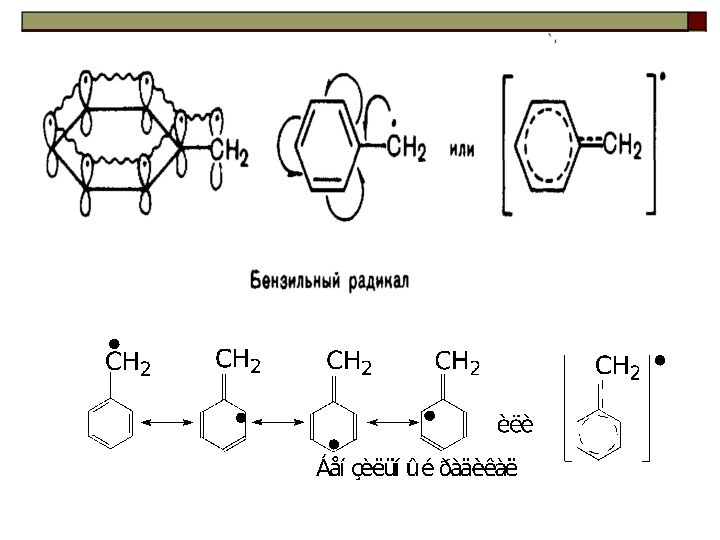
Ряд увеличения стабильности свободных радикалов:
(нужны электронодонорные заместители)
(нужны электроноакцепторные заместители)
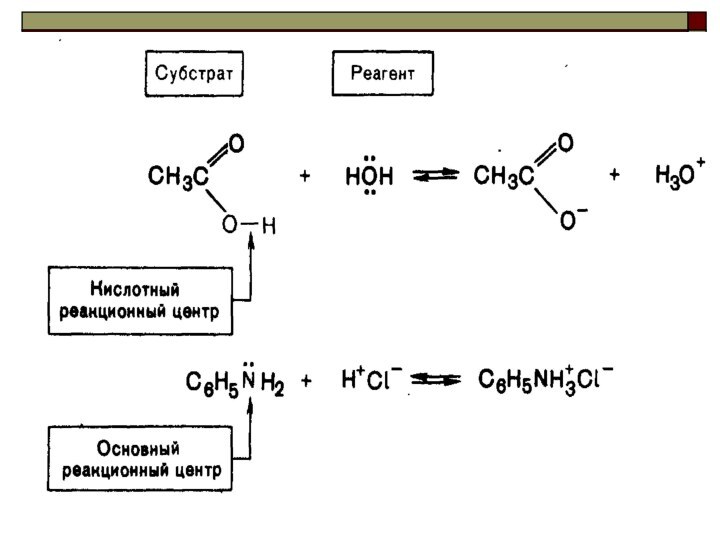
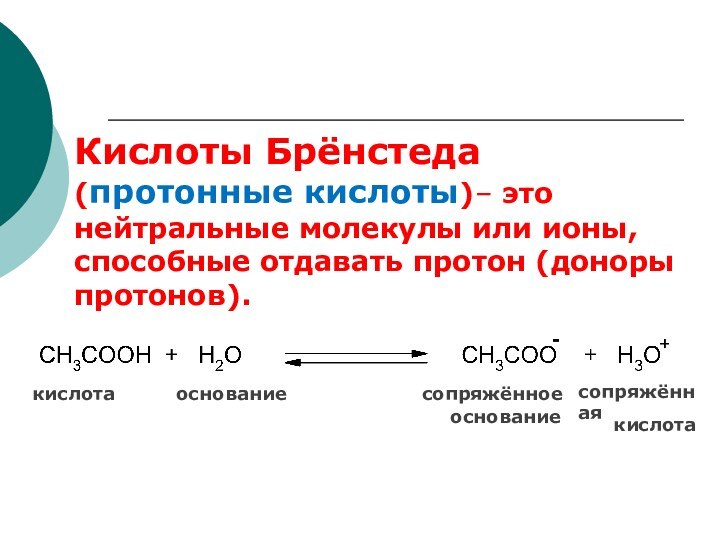
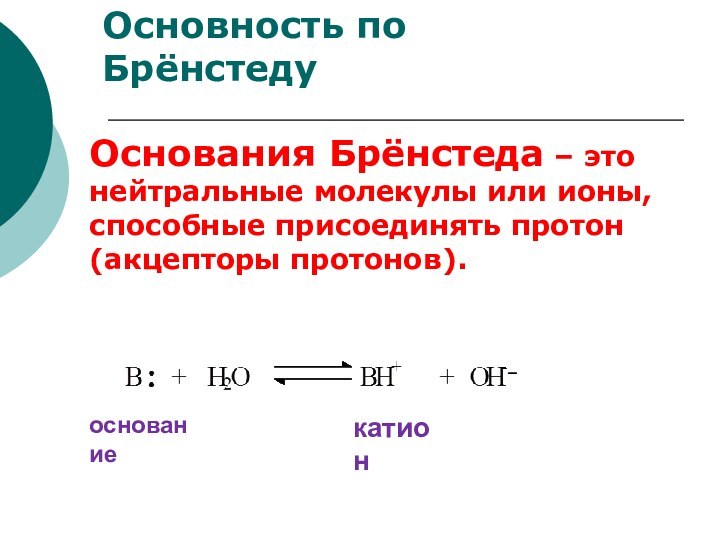
сопряжённая
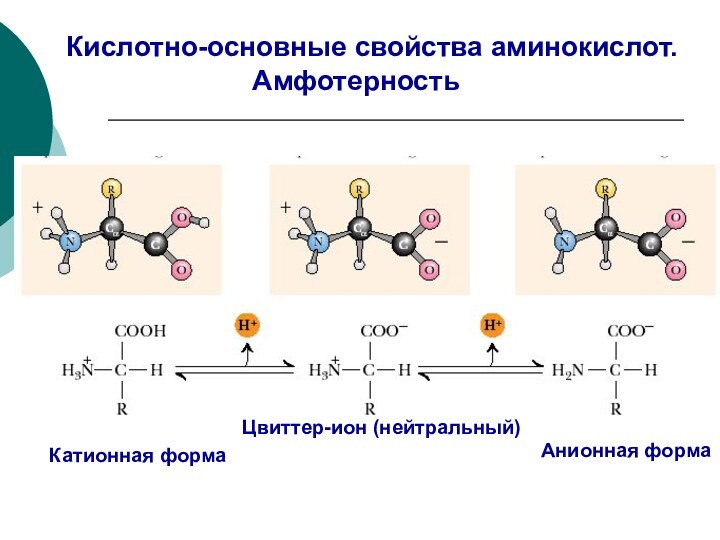
кислота основание сопряжённое
основание
кислота
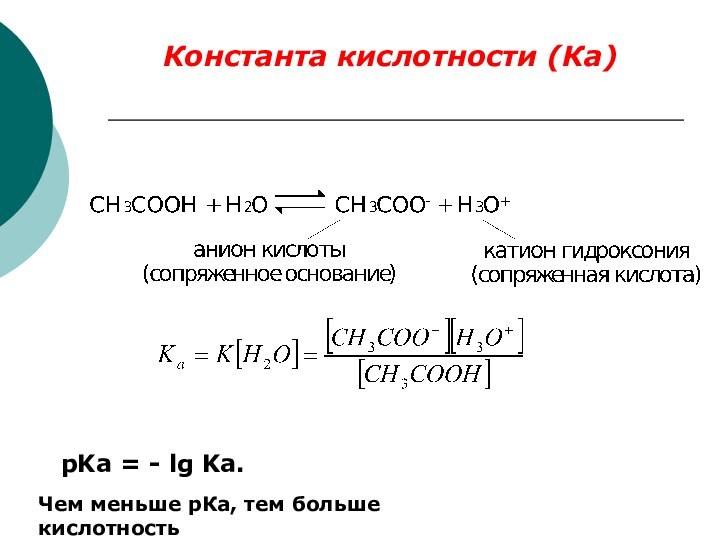
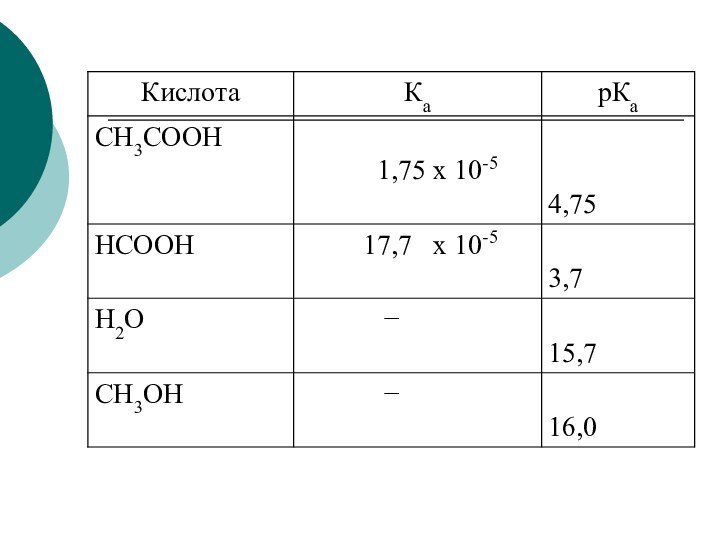
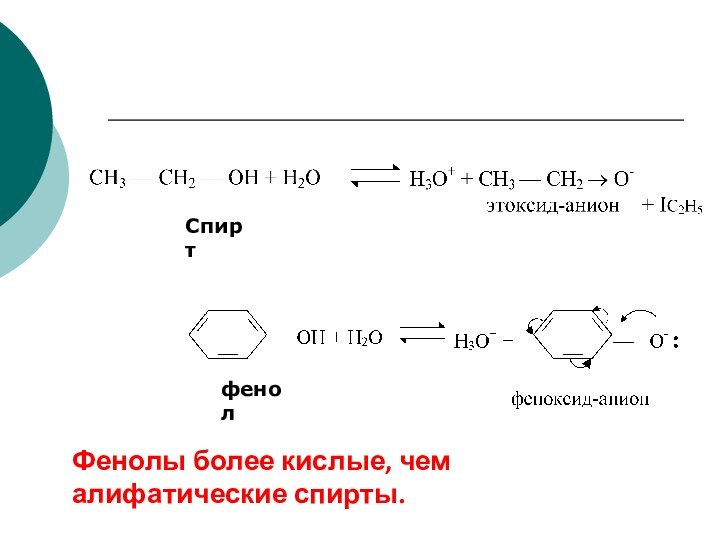
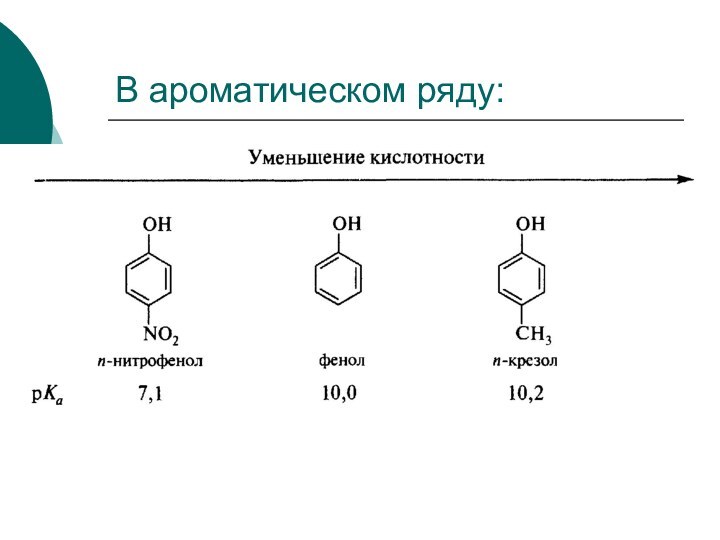
Качественной характеристикой кислотных свойств может служить стабильность образующегося аниона.
(Поляризуемость)
катион
основание
_