- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии: Фосфор и его соединения
Содержание
- 2. Открытие фосфора1669 год – немецкий алхимик
- 3. Положение в ПСХЭСтроение атома Р +15
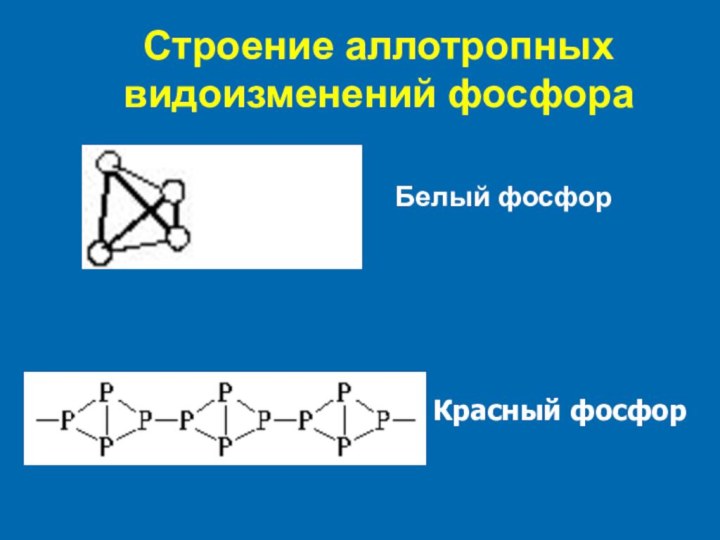
- 4. Аллотропные видоизмененияБелый фосфорКрасный фосфор
- 5. Строение аллотропных видоизменений фосфораБелый фосфорКрасный фосфор
- 6. Сравнительная характеристика свойств .
- 8. Взаимодействие с кислородом. 4Р°+502 =2Р+52O5
- 9. Фосфин с водородом фосфор непосредственно не реагирует,
- 10. Фосфор как окислитель Взаимодействие с металлами:2P°+3Mg =
- 11. Соединения фосфора
- 12. Оксид фосфора (V) 1. С водой:
- 13. Фосфорная кислота1.С металлами, стоящими в ряду напряжения
- 14. Качественная реакция на PO43-1.При действии раствора нитрата
- 15. Соли фосфорной кислотыСредние соли - фосфаты (Na3PO4)
- 16. Нахождение в природе
- 18. Апатит (содержит фосфат кальция)Производственное объединение «Фосфор»г.Чимкент
- 19. Биологическая роль фосфора.
- 20. У растений фосфор сосредоточен в семенах.
- 21. У животных - в нервной ткани, мышцах, скелете
- 22. Организм человека содержит около 1,5 кг
- 23. фосфора и его соединений. Применение
- 24. В военных целях
- 25. В спичечном производстве.
- 26. Синтетические моющие средства
- 27. Пищевые добавки и витамины
- 28. Производство удобрений.
- 29. Скачать презентацию
- 30. Похожие презентации
Открытие фосфора1669 год – немецкий алхимик Г. Бранд.(греч.фосфор) – «светоносный элемент»

























Слайд 3
Положение в ПСХЭ
Строение атома
Р +15 )
) )
2
8 5Возможные степени окисления: -3,0,+3,+5
Р0 +3ē → Р-3 – окислитель, восс-тся
Р0 - 5ē → Р+5 - восс-ль, окисляется
Определить степень окисления:
Р2О5, РН3, Са3Р2 РCl3, Р4
Слайд 8
Взаимодействие с кислородом.
4Р°+502 =2Р+52O5
белый Т = 40°С красный Т = 260°С черный Т = 400°С
Фосфор как восстановитель
Слайд 9
Фосфин
с водородом фосфор непосредственно не реагирует,
фосфин
РН3 можно получить косвенно, например:
Ca3P2+6HCl=3CaCl2 +2PH3 Фосфин - очень ядовитый газ с неприятным запахом!
Слайд 10
Фосфор как окислитель
Взаимодействие с металлами:
2P°+3Mg = Mg3P2-3
фосфид магния
легко разлагается водой
Mg3P2 + 6Н2О = 3Mg(OH)2 + 2РН3
фосфин
Слайд 12
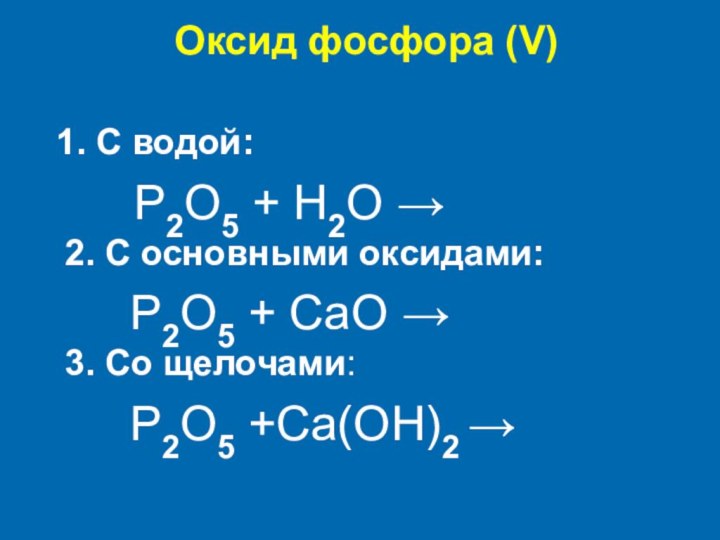
Оксид фосфора (V)
1. С водой:
P2O5 + H2O →
2. С основными оксидами:P2O5 + CaO → 3. Со щелочами:
P2O5 +Ca(OH)2 →
Слайд 13
Фосфорная кислота
1.С металлами, стоящими в ряду напряжения
металлов
до водорода:
Mg + H3PO4 →
2.С основными оксидами:
CaO +
H3PO4 → 3.С основаниями:
H3PO4 + NaOH →
4.С солями слабых кислот:
H3PO4 + Na2CO3 →
Слайд 14
Качественная реакция на PO43-
1.При действии раствора нитрата серебра
появляется желтый осадок:
Na3PO4 + 3AgNO3 → Ag3PO4 ↓
+ 3NaNO3
Слайд 15
Соли фосфорной кислоты
Средние соли - фосфаты (Na3PO4)
Кислые
соли - гидрофосфаты (Na2HPO4)
- дигидрофосфаты (NaH2PO4) Растворимы в воде фосфаты и
гидрофосфаты щелочных металлов и аммония.
Все дигидрофосфаты растворимы в воде.
Слайд 19
Биологическая роль фосфора.
Слайд 22
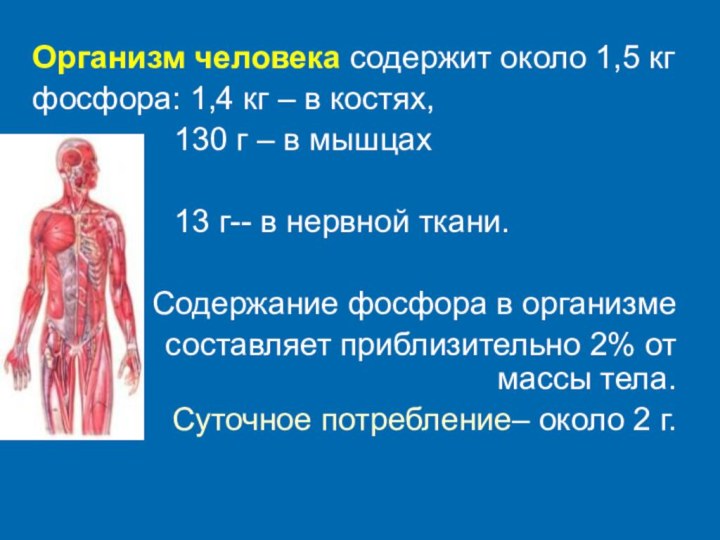
Организм человека содержит около 1,5 кг
фосфора:
1,4 кг – в костях,
130 г – в мышцах 13 г-- в нервной ткани.
Содержание фосфора в организме
составляет приблизительно 2% от массы тела.
Суточное потребление– около 2 г.





























