Слайд 2
Определение растворов.
Раствор - гомогенная система, состоящая из двух
или более компонентов.
Раствор состоит из растворенного вещества и растворителя.
Растворитель-
компонент раствора, существующий в одном агрегатном состоянии с раствором или преобладающий в растворе.
Растворы делят на истинные и коллоидные.
Состав растворов может изменяться в широких пределах.
Слайд 3
Концентрация растворов и способы ее выражения.
Концентрация раствора –
количество растворенного вещества, содержащееся в определенном количестве раствора или
растворителя.
Процентная концентрация (массовая доля, ω) – количество граммов растворенного вещества, содержащееся в 100 граммах раствора.
Мольная доля (N) – отношение числа молей данного вещества к общему числу молей в растворе.
Слайд 4
Способы выражения концентрации растворов.
Молярная концентрация раствора (См) –
количество вещества растворенного в 1000 мл раствора (1 л)
(выражается числом молей в одном литре раствора).
Нормальная концентрация или эквивалентная (Сн, Сэ) – выражается числом эквивалентов растворенного вещества в 1 л раствора.
Слайд 5
Теория электролитической диссоциации
Сванте Аррениус
(1859-1927)
В 1887 г. шведский
учёный
С. Аррениус предложил теорию
электролитической диссоциации
для объяснения особенностей
поведения водных растворов веществ.
Слайд 6
их растворы
или расплавы
ПРОВОДЯТ электрический
ток
их растворы
или расплавы
НЕ ПРОВОДЯТ электрический
ток
Вид химической связи
Ионная или ковалентная
сильно полярная
Ковалентная неполярная
или мало полярная
Все вещества по отношению к электрическому току можно разделить на
Слайд 7
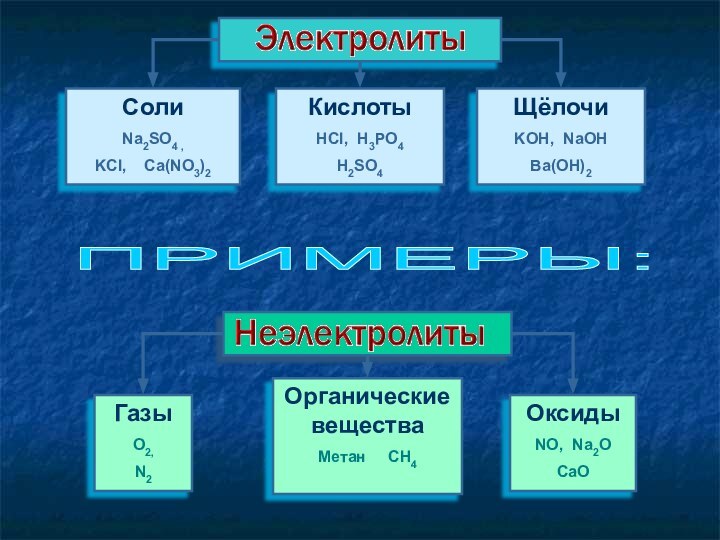
Cоли
Na2SO4 ,
KCl, Ca(NO3)2
Кислоты
HCl, H3PO4
H2SO4
Щёлочи
KOH, NaOH
Ba(OH)2
Газы
O2,
N2
Органические вещества
Метан
CH4
Оксиды
NO, Na2O
CaO
ПРИМЕРЫ:
Слайд 8
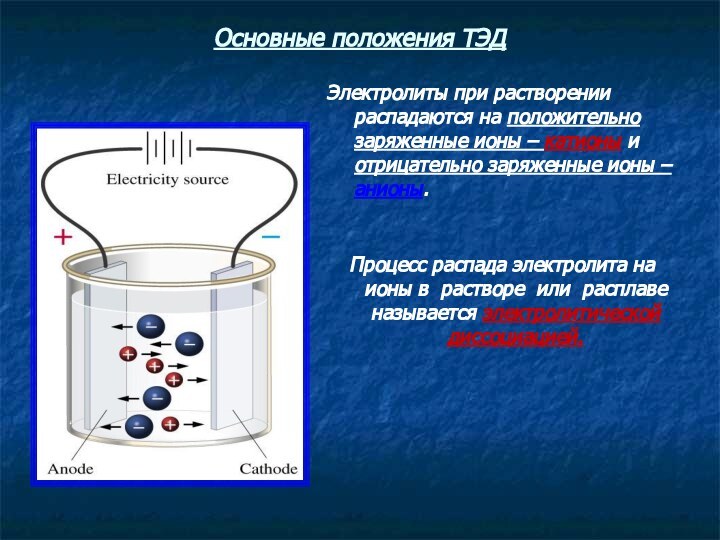
Основные положения ТЭД
Электролиты при растворении распадаются на положительно
заряженные ионы – катионы и отрицательно заряженные ионы –
анионы.
Процесс распада электролита на ионы в растворе или расплаве называется электролитической диссоциацией.
Слайд 9
Причины распада вещества на ионы в расплавах
Нагревание
усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка
разрушается.
Слайд 10
Молекула воды является диполем
Электронная формула воды – Н : О :
Пространственное строение
Структурная формула Н→О
Н
Роль молекул растворителя в процессе электролитической диссоциации
Н
Слайд 11
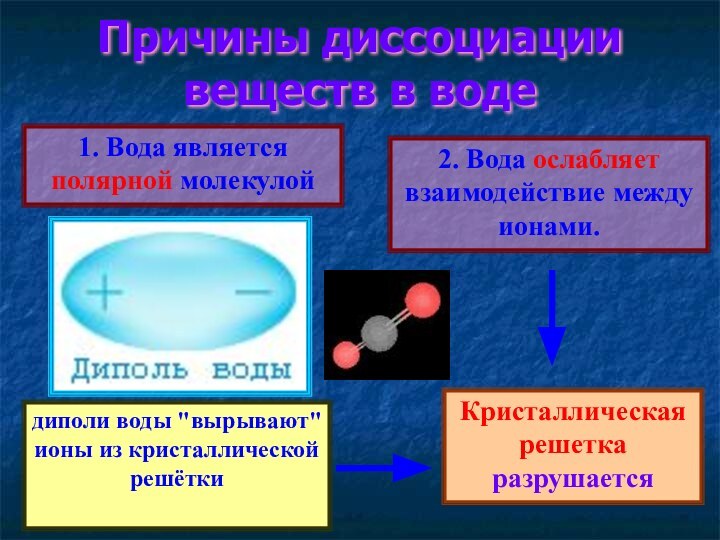
Причины диссоциации веществ в воде
1. Вода является
полярной молекулой
2. Вода ослабляет взаимодействие между ионами.
диполи
воды "вырывают" ионы из кристаллической решётки
Кристаллическая решетка разрушается
Слайд 13
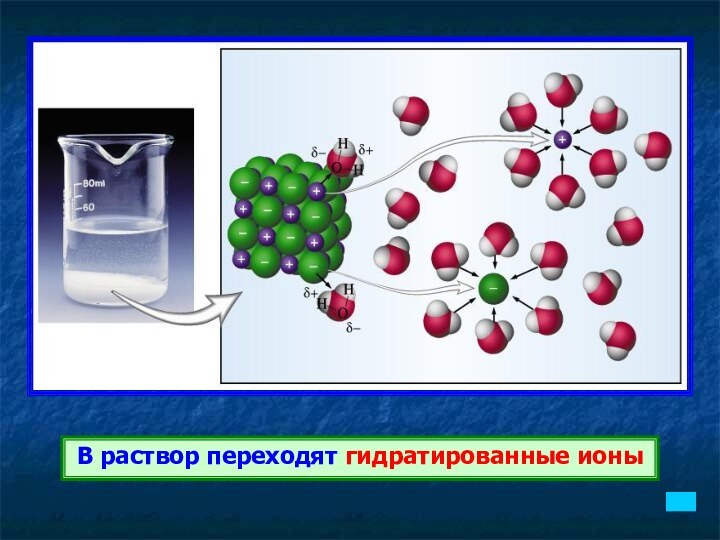
В раствор переходят гидратированные ионы
Слайд 14
Диссоциация соединений с ковалентной полярной связью
Слайд 15
Образование в результате распада электролитов гидратированных ионов отражается
при написании уравнений диссоциации, однако, чаще эти уравнения записывают
в более короткой форме
Cl-
HNO3 = H+ + NO3-
HClO4 = H+ + ClO4-
Кислоты – это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка.
Диссоциация кислот
Слайд 17
Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает
хуже предыдущей.
Сильный электролит
H2SO4⮀H++ HSO4-α1
HSO4 - ⮀H++ SO42-α2
α1≈ α2
H2SO4⮀2H++ SO42-
Электролит
средней силы
H2SO3⮀H++ HSO3-α1
HSO3 - ⮀H++ SO32-α2
α1>> α2
H2SO3⮀H++ HSO3-
Слайд 18
NaOH = Na+ + OH-
Ba(OH)2 = BaOH+ +
OH- → Ba2+ + 2OH-
KOH = K+ + OH-
Основания – это электролиты, которые диссоциируют на катионы металла и анионы гидроксогрупп
Диссоциация оснований
Слайд 19
Соли – это электролиты,
которые
диссоциируют на катионы металла или аммония NH4+
и анионы кислотных остатков.
NaCl = Na+ + Cl-
KNO3 = K+ + NO3-
Al2(SO4)3 = 2Al3+ + 3SO42-
Диссоциация солей
Слайд 20
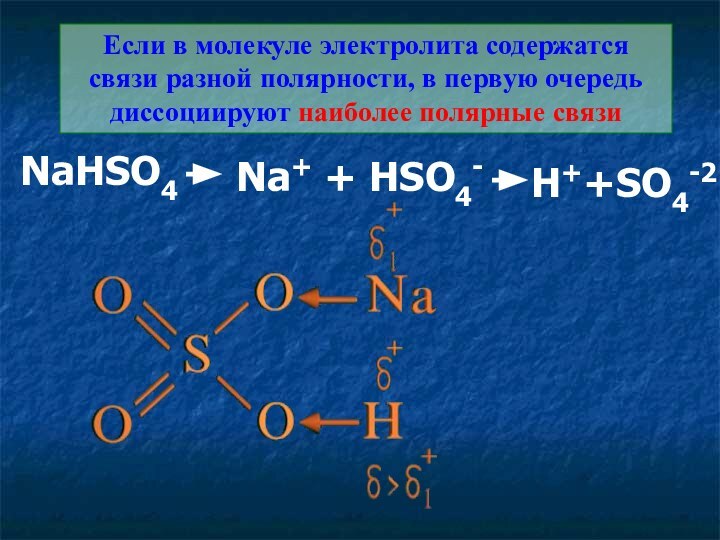
Если в молекуле электролита содержатся связи разной полярности,
в первую очередь диссоциируют наиболее полярные связи
NaHSO4
Na+ + HSO4-
H++SO4-2
Слайд 21
Количественная характеристика процесса диссоциации
Степень диссоциации – отношение числа
распавшихся на ионы молекул к общему числу молекул в
растворе.
Слайд 23
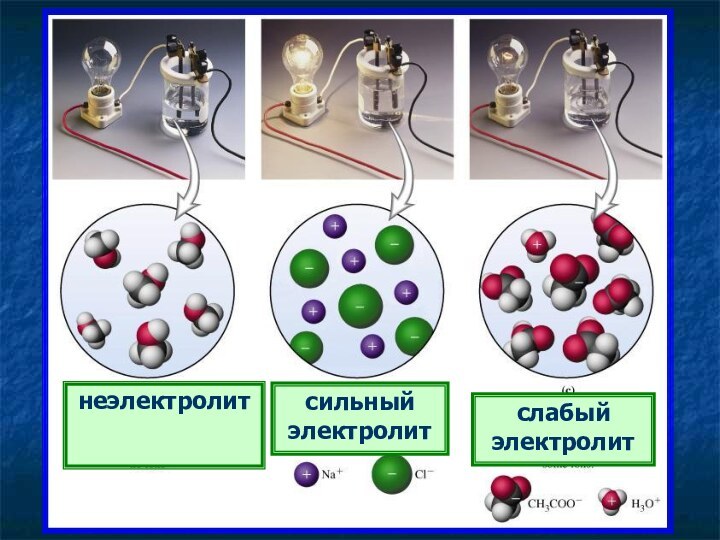
неэлектролит
сильный электролит
слабый электролит
Слайд 24
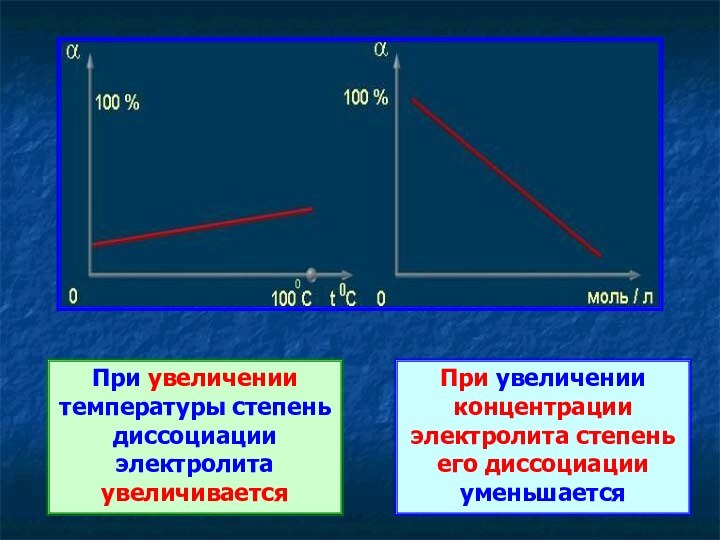
При увеличении температуры степень диссоциации электролита увеличивается
При увеличении
концентрации электролита степень его диссоциации уменьшается
Слайд 25
Константа диссоциации
Характеризует способность
слабого электролита распадаться на ионы
Слайд 26
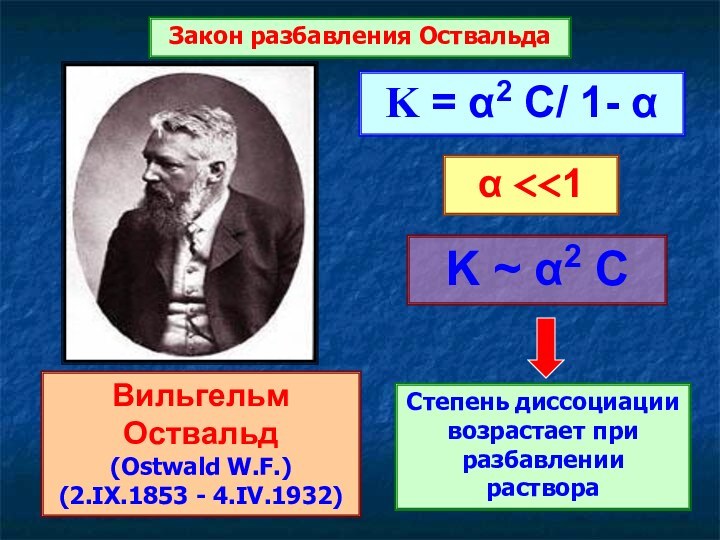
Вильгельм Оствальд
(Ostwald W.F.)
(2.IX.1853 - 4.IV.1932)
Закон разбавления Оствальда
K ~
α2 C
Степень диссоциации возрастает при разбавлении раствора
K = α2
C/ 1- α
α <<1
Слайд 27
ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ
И.Н.БРЕНСТЕДА
(1923 год)
Cоединения, которые в своём
составе не
содержат ОН ¯ групп
NH3; PH3; амины; пиридин
при растворении в
воде образуют
ОН ¯ группы
NH3 + HOH NH4+ + OH¯
Слайд 28
ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ
И.Н.БРЕНСТЕДА
ОСНОВАНИЯ – вещества, способные присоединять к себе
протон водорода
КОН + СH3СООН H2O
+ CH3COOK
OH¯ + СH3СООН H2O + CH3COO¯
H2O + H+ H3O+
CO32- + H+ HCO3¯
PO43- + H+ HPO42-
Слайд 29
ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ
И.Н.БРЕНСТЕДА
КИСЛОТЫ – вещества, способные отщеплять протон водорода
HCl
H+ + Cl¯
HCO3¯
H+ + CO32-
NH4+ H+ + NH3
H3O+ H+ + H2O
PH4+ H+ + PH3
Слайд 30
Реакции в растворах электролитов протекают до конца если:
Образуется
или растворяется осадок
AgNO3 + NaCl --> AgCl(осадок) + NaNO3
Выделяется
газ
K2S + 2HCl --> H2S(газ) + 2KCl
Образуется малодиссоциирующее вещество (например Н2О)
HCl + NaOH --> NaCl + H2O
Условия протекания реакции ионного обмена
Слайд 31
Произведение растворимости (ПР) — произведение концентрации ионов малорастворимого электролита
в его насыщенном растворе при постоянной температуре и давлении.
Произведение растворимости — величина постоянная.
Слайд 34
Гидролиз солей
Гидролиз - обменное химическое взаимодействие катионов или
анионов соли с молекулами воды в результате которого образуется
слабый электролит.
Любая соль – продукт взаимодействия основания и кислоты. В зависимости от силы основания и кислоты выделяют четыре типа солей.
Слайд 36
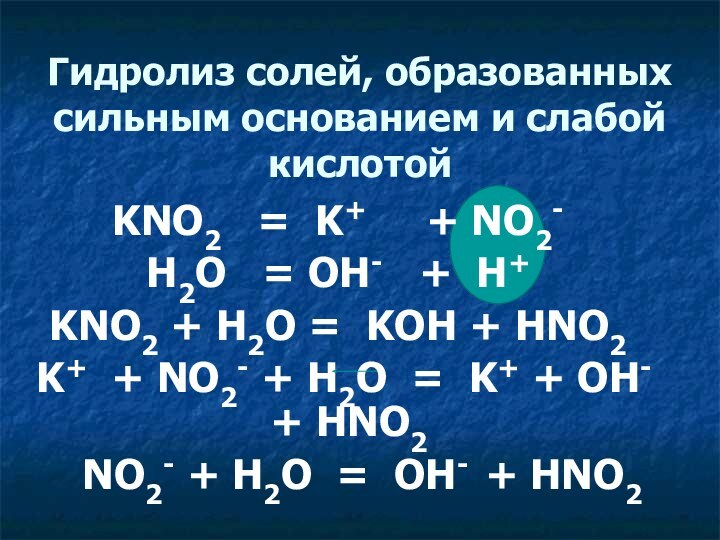
KNO2 = K+ + NO2-
H2O = OH- + H+
KNO2 + H2O
= KOH + HNO2
K+ + NO2- + H2O = K+ + OH- + HNO2
NO2- + H2O = OH- + HNO2
Гидролиз солей, образованных сильным основанием и слабой кислотой
Слайд 37
Гидролиз солей, образованных слабым основанием и сильной кислотой
NiCl2 = Ni2+ + 2Cl-
H2O = OH-
+ H+
NiCl2 + H2O = NiOHCl + HCl
Ni2+ + 2Cl- + H2O = NiOH+ + 2Cl- + H+
Ni2+ + H2O = NiOH+ + H+
Слайд 38
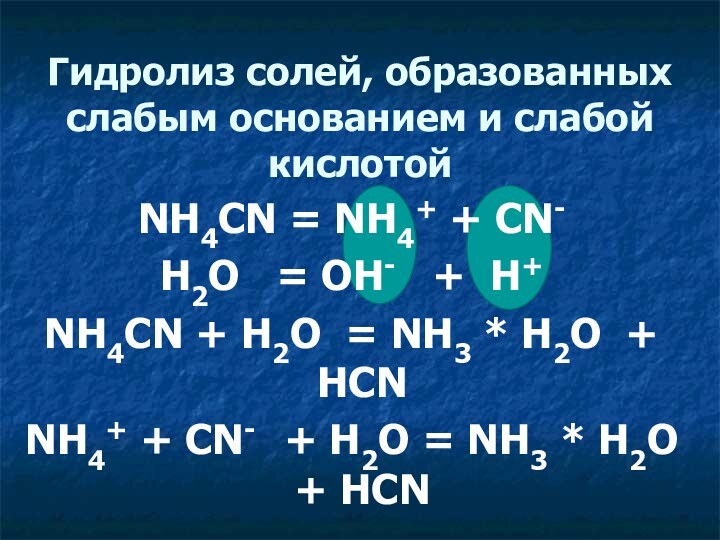
Гидролиз солей, образованных слабым основанием и слабой кислотой
NH4CN = NH4+ + CN-
H2O = OH-
+ H+
NH4CN + H2O = NH3 * H2O + HCN
NH4+ + CN- + H2O = NH3 * H2O + HCN
Слайд 39
Гидролиз солей, образованных сильным основанием и сильной кислотой
не происходит
KCl = K+ + Cl-
H2O =
OH- + H+
KCl + H2O ≠ KOH + HCl
K+ + Cl- + H2O? K+ + Cl- + OH- + H+
H2O ? OH- + H+