- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Кислородсодержащие кислоты хлора
Содержание
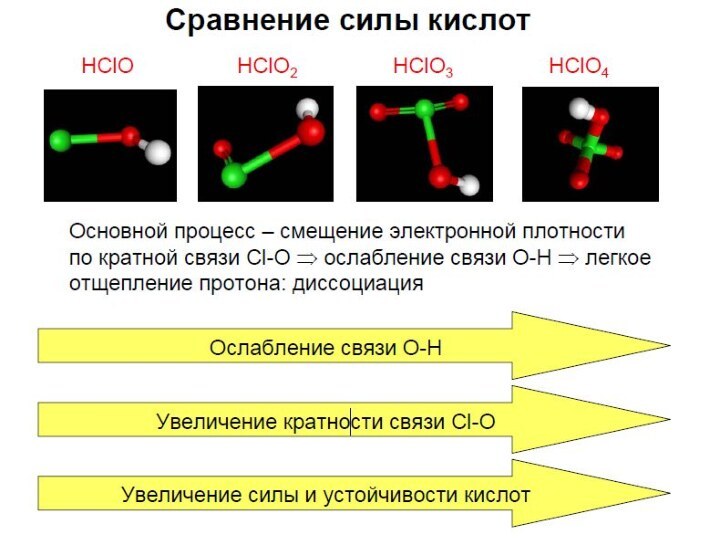
- 2. Хлорноватистая кислота HClO
- 3. Строение
- 4. Физические свойстваВ свободном виде не выделена. Существует
- 5. ПолучениеСпособы получения:Реакция хлора с влажным оксидом ртути.2Cl2
- 6. Химические свойстваХлорноватистая кислота очень неустойчива и может
- 7. Химические свойстваВзаимодействует с основаниями:HClO + NaOH =
- 8. ПрименениеХлорноватистая кислота и гипохлориты легко разлагаются с
- 9. Хлористая кислота HClO2
- 10. Строение
- 11. Физические свойстваВ свободном виде не выделена. Существует в разбавленном бесцветном растворе.
- 12. ПолучениеРаствор кислоты получают из её солей - хлоритов,
- 13. Химические свойстваХлористая кислота НClO2 в свободном виде неустойчива,
- 14. ПрименениеШироко применяют только соли хлористой кислоты –
- 15. Хлорноватая кислота HClO3
- 16. Строение
- 17. Физические свойстваВ свободном виде не выделена. Существует в бесцветном растворе, максимальная массовая доля 40%.
- 18. ПолучениеХлорноватая кислота образуется при: разложении хлорноватистой кислоты3HClO =
- 19. Химические свойстваХлорноватая кислота — сильный окислитель; окислительная
- 20. ПрименениеШироко используют только соли хлорноватой кислоты –
- 21. Хлорная кислота HClO4
- 22. Строение
- 23. Физические свойства Неустойчивая бесцветная летучая жидкость, t°кип. = 110°C,
- 24. ПолучениеВодные растворы хлорной кислоты получают электрохимическим окислением
- 25. Химические свойстваХлорная кислота при хранении при комнатной
- 26. Химические свойстваХлорная кислота слабый окислитель в разбавленном,
- 27. ПрименениеКонцентрированные водные растворы хлорной кислоты широко используются
- 29. Скачать презентацию
- 30. Похожие презентации
Хлорноватистая кислота HClO


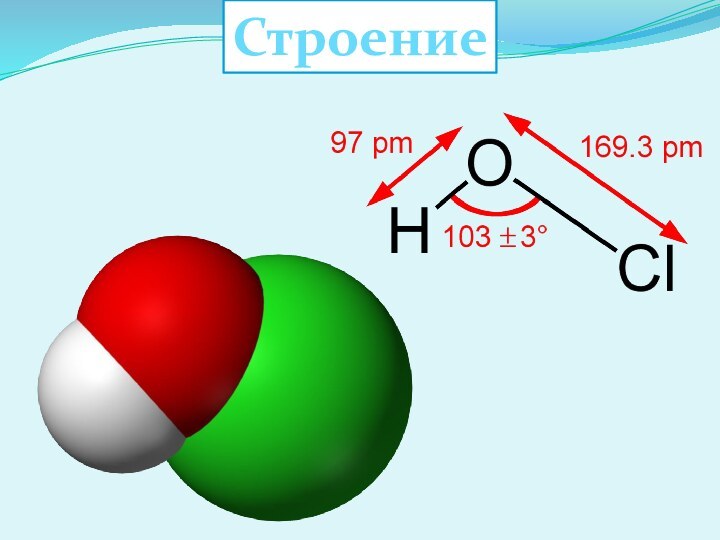

























Слайд 5
Получение
Способы получения:
Реакция хлора с влажным оксидом ртути.
2Cl2 +
H2O + HgO = HgCl2 + 2HClO
2) Растворение оксида
хлора(I) в воде.Cl2O + H2O = 2HClO
В промышленном масштабе производятся только соли: гипохлориты кальция, натрия, калия, лития (хлорированием известкового молока и соответствующих щелочей).
Слайд 6
Химические свойства
Хлорноватистая кислота очень неустойчива и может (в
зависимости от условий) разлагаться по трем направлениям:
Последняя реакция
идет под действием водоотнимающих средств, например CaCl2
Слайд 7
Химические свойства
Взаимодействует с основаниями:
HClO + NaOH = NaClO
+ H2O
HClO + NH3 ∙ H2O(конц.) = N2 +
3NH4Cl + 8H2OХлорноватистая кислота сильный окислитель:
MnS + 4HClO = MnSO4 + 4HCl
HClO + 2HI = HCl + I2 + H2O
HClO + H2O2 = HCl + O2 + H2O
HClO + H3AsO3 = H3AsO4 + HCl
Может взаимодействовать с другими кислотами хлора
HClO + HCl = Cl2 + H2O
HClO + HClO2 = HCl + HClO3
Слайд 8
Применение
Хлорноватистая кислота и гипохлориты легко разлагаются с выделением
атомарного кислорода и поэтому широко используются для отбелки целлюлозы и тканей, а также
для санитарных целей. Однако в промышленном масштабе производят только гипохлориты (кальция, натрия и лития).
Слайд 11
Физические свойства
В свободном виде не выделена. Существует в
разбавленном бесцветном растворе.
Слайд 12
Получение
Раствор кислоты получают из её солей - хлоритов, образующихся
в результате взаимодействия ClO2 со щелочью:
Ba(ClO2)2 + H2SO4 = BaSO4 +2HClO2
Также хлористую кислоту можно получить по реакциям:
2ClO2 +H2O2 = 2HClO2 + O2
ClF3 + 2H2O = 3HF + HClO2
Слайд 13
Химические свойства
Хлористая кислота НClO2 в свободном виде неустойчива, даже
в разбавленном водном растворе она быстро разлагается:
Проявляет окислительно-восстановительные
свойстваHClO2 + 4HI = HCl +2I2 + 2H2O
5HClO2 + 2KMnO4 + 3H2SO4 = 5HClO3 + 2MnSO4 + K2SO4+ 3H2O
Нейтрализуется щелочами
HClO2 + NaOH = NaClO2 + H2O
Слайд 14
Применение
Широко применяют только соли хлористой кислоты – хлориты.
В частности наиболее широко используется хлорит натрия NaClO2, применяемый
для отбелки тканей и бумажной массы.
Слайд 17
Физические свойства
В свободном виде не выделена. Существует в
бесцветном растворе, максимальная массовая доля 40%.
Слайд 18
Получение
Хлорноватая кислота образуется при: разложении хлорноватистой кислоты
3HClO = HClO3
+ 2HCl
при электролизе растворов хлоридов.
В лабораторных условиях хлорноватую кислоту
получают при взаимодействии хлората бария с разбавленной серной кислотой:Ba(ClO3)2 + H2SO4 = BaSO4 + 2HClO3
Слайд 19
Химические свойства
Хлорноватая кислота — сильный окислитель; окислительная способность
увеличивается с возрастанием концентрации и температуры. HClO3 легко восстанавливается до
соляной кислоты:В слабокислой среде HClO3 восстанавливается сернистой кислотой H2SO3 до Cl−, но при пропускании смеси SO2 и воздуха сквозь сильнокислый раствор, образуется диоксид хлора:
В 40%-ной хлорноватой кислоте воспламеняется, например, фильтровальная бумага.
При нагревании разлагается:
3HClO3= HClO4+ 2ClO2+ H2O
Слайд 20
Применение
Широко используют только соли хлорноватой кислоты – хлораты.
Наибольшее практическое применение имеет хлорат калия KClO3 , потребляемый
для производства спичек, пиротехнических составов, пороха, ракет. Другой хлорат – натрия используется для уничтожения сорняков. Также для борьбы с сорняками широко используют хлораты кальция и магния.
Слайд 23
Физические свойства
Неустойчивая бесцветная летучая жидкость,
t°кип. = 110°C, t°пл.=
-101°C. На воздухе сильно дымит. Вещество хорошо растворимо в
хлор- и фторорганических растворителях, таких как CH2Cl2 (хлористый метилен), CHCl3 (хлороформ) и другие.Хорошо смешивается с водой (H2O) в любых соотношениях. Концентрированные растворы данной кислоты обладают немного маслянистой консистенцией. Плотность 1.76 г/см³.
Водные растворы хлорной кислоты обладают хорошей электропроводимостью.
Слайд 24
Получение
Водные растворы хлорной кислоты получают электрохимическим окислением соляной
кислоты
Процесс электрохимического синтеза хлорной кислоты на аноде описывается следующим
суммарным уравнением:НСL + 4Н2О – 8e - ― НСLO4 + 8H +
На катоде происходит выделение водорода.
Также хлорную кислоту получают обменным разложением перхлоратов натрия или калия сильными неорганическими кислотами
KClO4 + H2SO4(конц) = KHSO4 + HClO4
Слайд 25
Химические свойства
Хлорная кислота при хранении при комнатной температуре
медленно разлагается, что обнаруживается по потемнению жидкости вследствие окрашивания
ее продуктами разложения:3HClO4 =τ= Cl2O7 + HClO4 ∙ H2O
Такая кислота опасна при хранении, так как может самопроизвольно взрываться. Поэтому обычно безводную хлорную кислоту не хранят, а стараются готовить непосредственно перед ее использованием.
Слайд 26
Химические свойства
Хлорная кислота слабый окислитель в разбавленном, сильный
окислитель в концентрированном растворе при нагревании.
Безводная хлорная кислота весьма
реакционно-способна, при соприкосновении со многими легкоокисляющимися органическими веществами она взрывается. Элементарный фосфор и сера окисляются хлорной кислотой до фосфорной и серной кислоты:4S + 3HClO4 +4H2O = 4H2SO4 + 3HCl
Иод окисляется хлорной кислотой:
2HClO4 + I2 + 4H2O= 2H5IO6 + Cl2
Однако бром, хлор, а также НВг и НСL не взаимодействуют с нею даже при нагревании.
Слайд 27
Применение
Концентрированные водные растворы хлорной кислоты широко используются в
аналитической химии (например, при количественном определении калия в виде
малорастворимого перхлората калия), а также для получения перхлоратов.Хлорная кислота применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора.
Соли хлорной кислоты: перхлорат калия малорастворим в воде, применяется в производстве взрывчатых веществ, перхлорат магния (ангидрон) — осушитель.