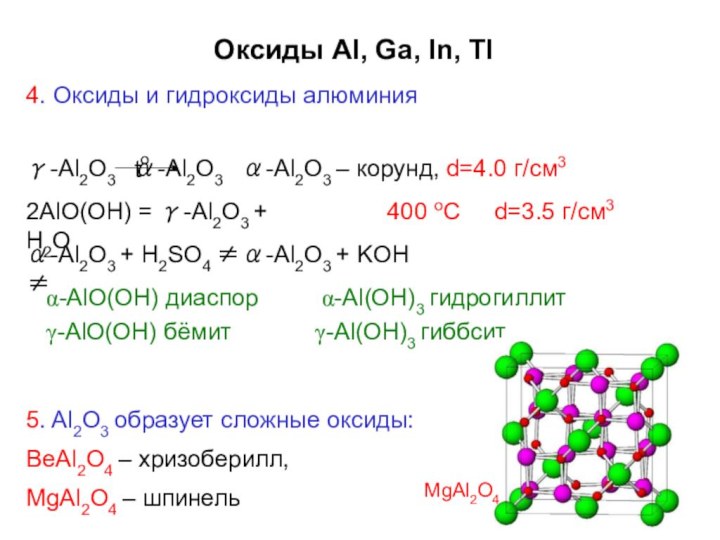
d(Ga–Ga) = 247 пм
[+270+274+279 (×2)]
In –
тетрагональная решетка,
искажение структуры железа,
к.ч.=12Tl –
гексагональная структура типа магния, к.ч.=12
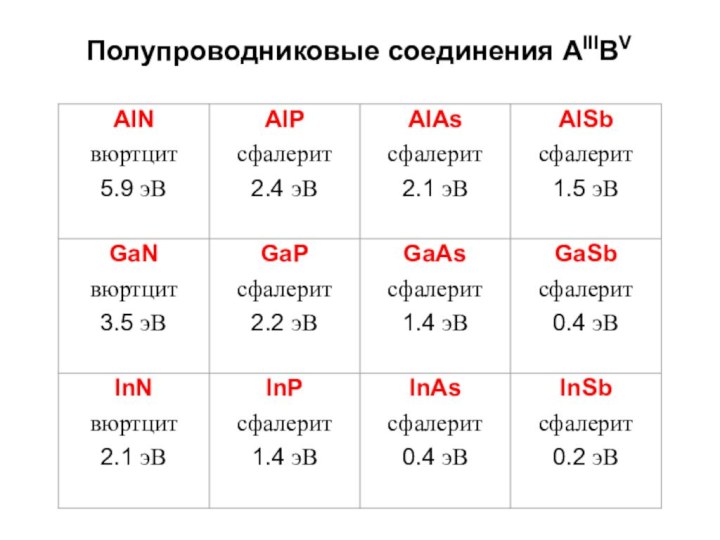
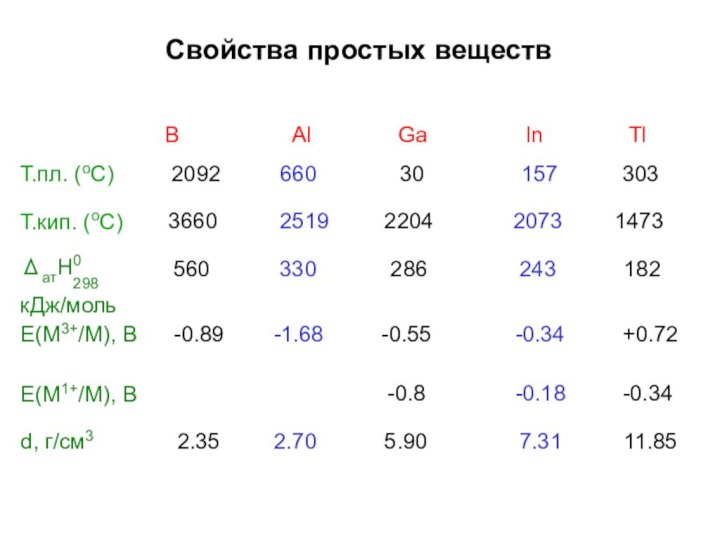
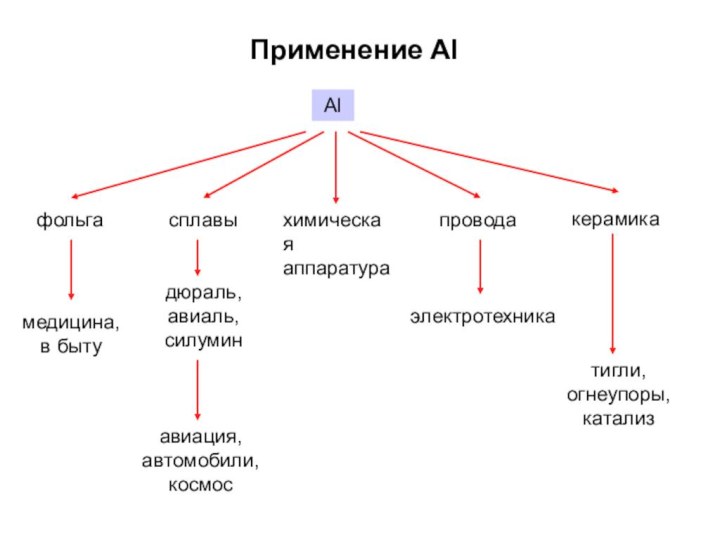
Строение простых веществ





![Исходная презентация Подгруппа алюминия для подготовки урока химии на повышенном уровне Соединения Al, Ga, In, Tl с водородомLi[AlH4]MHNH3AlH3MClC2H2NHClHOROHNH31. Получение4LiH + AlCl3 Li[AlH4] + 3LiCl2Li[AlH4]](/img/tmb/6/598922/13457d371068ddd0164fa92ce9072a78-720x.jpg)




![Исходная презентация Подгруппа алюминия для подготовки урока химии на повышенном уровне Аквакомплексы Al[Al13O4(OH)24(H2O)12]7+K(H2O)6 Al(H2O)6SO4KAl(SO4)2·12H2OAl(H2O)63+ ⇔ [Al(H2O)5(OH)]2+ + H+ [Al(H2O)5(OH)]2+ ⇔ [(H2O)4Al(OH)2Al(H2O)4]4+гидролиз димеризацияТакже известны](/img/tmb/6/598922/35db9f6e4e01593b8f9228439b556f8c-720x.jpg)
![Исходная презентация Подгруппа алюминия для подготовки урока химии на повышенном уровне In(OSO2CF3) ⋅ [18]crown-6{In ⋅ 2[15]crown-5}+Стабилизация In(I)](/img/tmb/6/598922/0abc7d1ee94569dc3b3c8853b57e4863-720x.jpg)