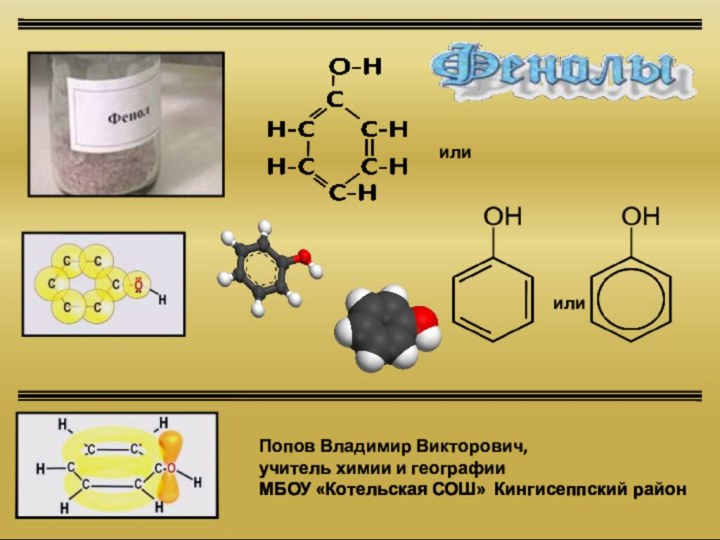
которых одна или несколько гидроксогрупп непосредственно связаны с атомами
углерода бензольного кольца:фенол
(гидроксибензол)
м.-крезол
(3-гидрокситолуол,
или 3-метилфенол)
пирокатехин
(1,2-дигидроксибензол)
пирогаллол
(1,2,3-тригидроксибензол)
!!! Фенолы необходимо отличать от ароматических спиртов:
бензиловый спирт