- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Биохимия ферментов
Содержание
- 2. ФерментыБактериальное брожениеФизиологическая регуляцияКатализКлеточный метаболизмМакромолекулыПитаниеГенетический аппаратУльтраструктура
- 3. ФерментМолекулярная массаФерментМолекулярная
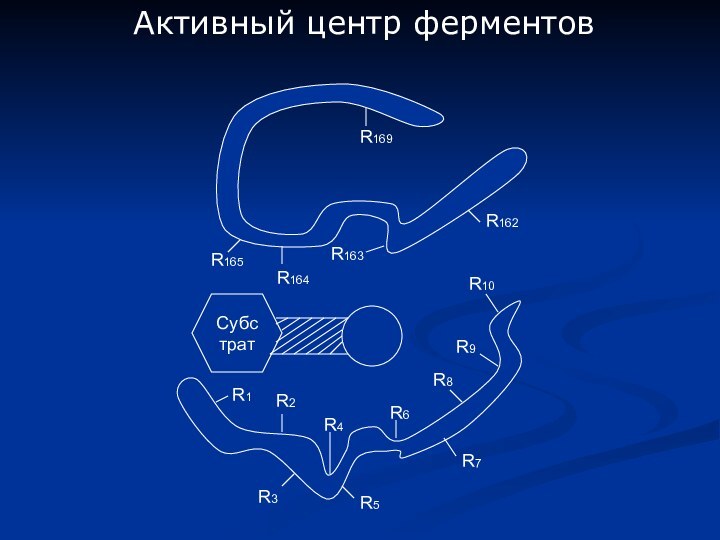
- 4. Активный центр ферментовСубстрат R1R2R3R5R4R6R7R8R9R10R165R164R163R162R169
- 5. Распределение и относительные количества изоферментов
- 6. Механизм действия ферментов Субстрат +ФерментАктивныйкомплексПродукты реакцииФермент
- 7. - - - - - -
- 8. - - - - - - -
- 9. - - - - - -
- 10. Уравнение Михаэлиса - Ментен VMAX ..[ s ]Кs+[ s ]v =
- 11. - - - - - -
- 12. Определение численного значения КmЕсли v
- 13. График Лайнувера – Берка.1vmax1KmНаклон = К mV max1v1[s]
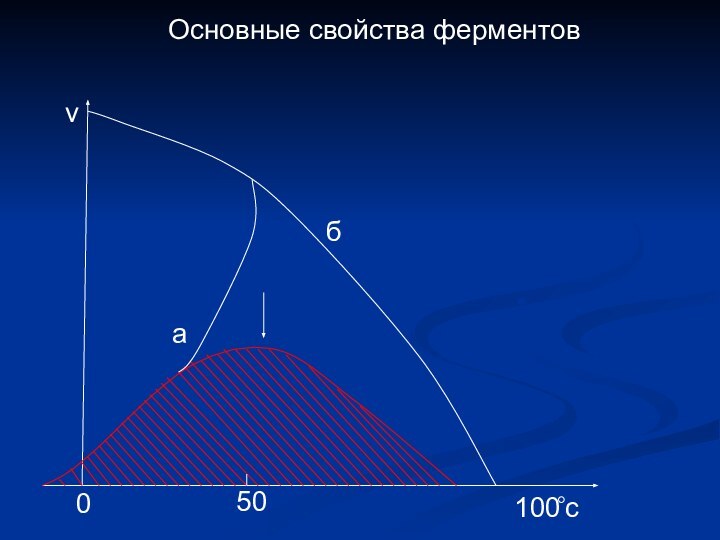
- 14. Основные свойства ферментовабv1000c50
- 15. Зависимость скорости катализируемой ферментом
- 16. Оптимальные значения рН для некоторых ферментовФерментрнФерментрнПепсин1,5 –
- 17. Торможение активности СДГ малоновой кислотой++ООСООСССНННН - 2НООССНСНООС;++ООСООССНБлокиро-вание реакцииСукцинатФумаратМалонат
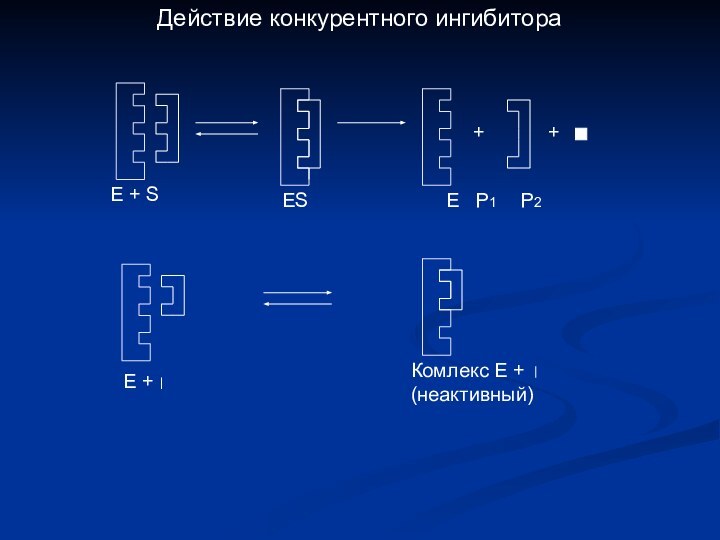
- 18. + +Е + Комлекс Е +(неактивный)
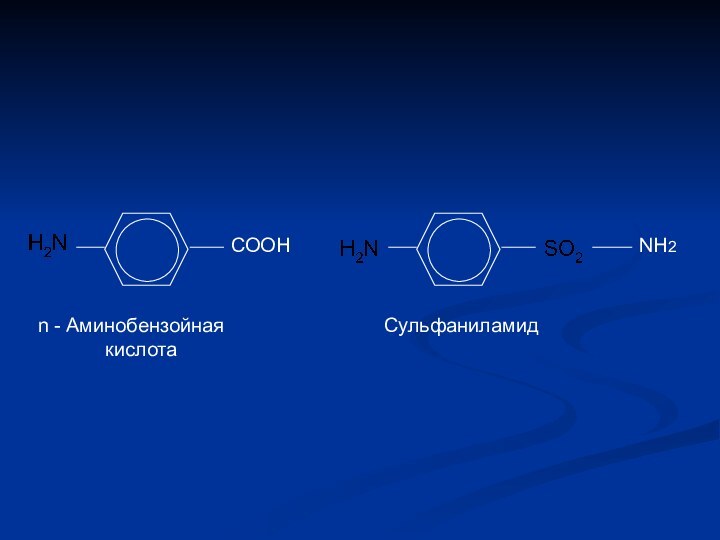
- 19. СООНNH2n - Аминобензойная кислотаСульфаниламид
- 20. - - - - - - -
- 21. - - - - - - -
- 22. - - - - - - -
- 23. Скачать презентацию
- 24. Похожие презентации




![Биохимия ферментов Уравнение Михаэлиса - Ментен VMAX ..[ s ]Кs+[ s ]v =](/img/tmb/11/1065330/472078b824b421df90886e95cd7955fe-720x.jpg)

![Биохимия ферментов График Лайнувера – Берка.1vmax1KmНаклон = К mV max1v1[s]](/img/tmb/11/1065330/0aa656ca53b50db831dc88ff6ab26963-720x.jpg)




Слайд 2
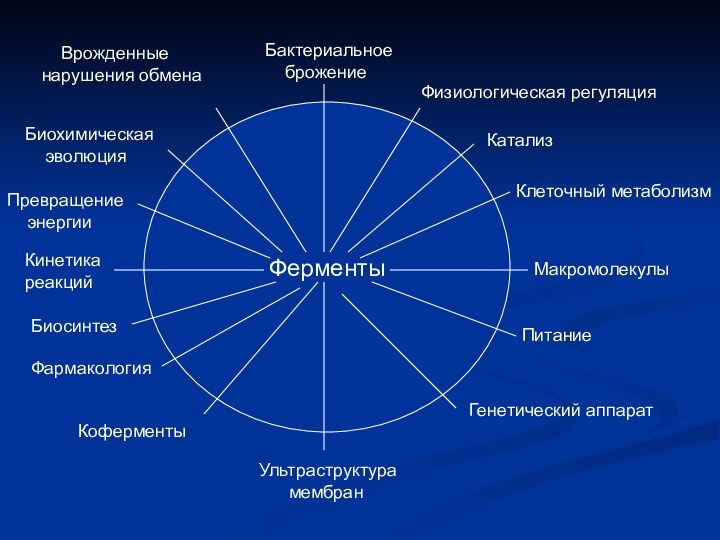
Ферменты
Бактериальное
брожение
Физиологическая регуляция
Катализ
Клеточный метаболизм
Макромолекулы
Питание
Генетический аппарат
Ультраструктура
мембран
Слайд 3
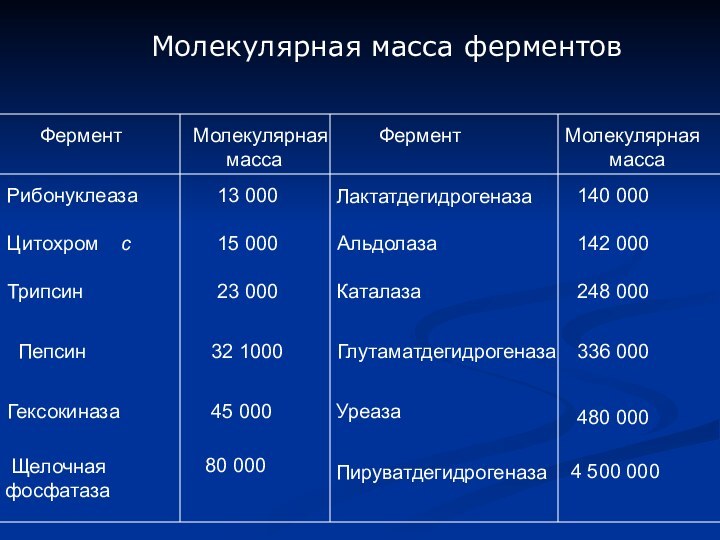
Фермент
Молекулярная
масса
Фермент
Молекулярная
масса
Рибонуклеаза
13 000
Лактатдегидрогеназа
140 000
Цитохром с
15 000
Альдолаза
142 000
Трипсин
23
000 Каталаза
248 000
Пепсин
32 1000
Глутаматдегидрогеназа
336 000
Гексокиназа
45 000
Уреаза
480 000
Щелочная
фосфатаза
80 000
Пируватдегидрогеназа
4 500 000
Молекулярная масса ферментов
Слайд 5
Распределение и относительные количества изоферментов
ЛДГ
ЛДГ1
- - - - - - - - - - - -
ЛДГ2
ЛДГ3
ЛДГ4
Старт
+
-
ЛДГ5
- - - -
Сердце
Почки
Печень
Мышцы
Слайд 7 - - - - - - -
- -
- - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - G
Исходное
состояние
_ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
ЕНФ
Еф
Р
Переходное
состояния
Конечное состояние
Ход реакции
Свободная энергия
S
Энергетический механизм ферментативной и неферментативной
химических реакций
Слайд 8
- - - - - -
- -
- -
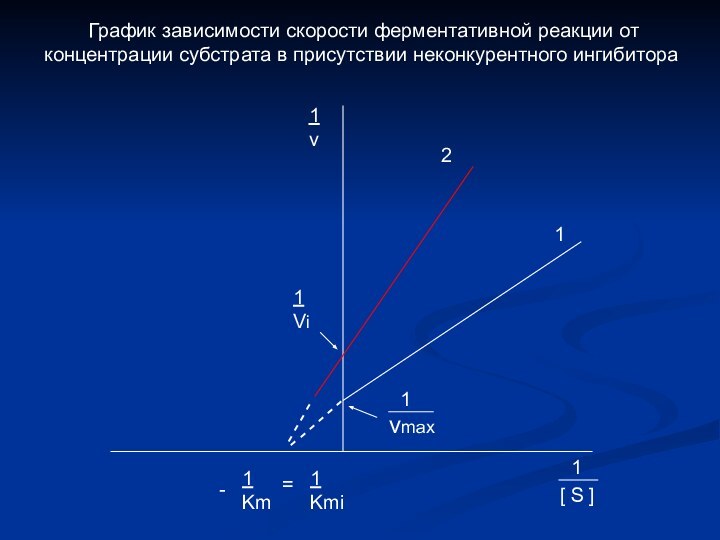
1
Km
1
Kmi
=
1
v
2
1
[ S ]
1
-
1
Vi
1
vmax
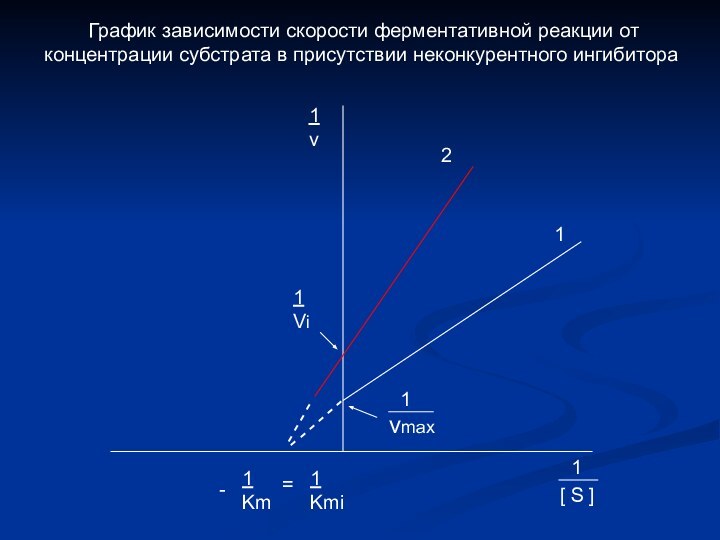
График зависимости скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора
Слайд 9
- - - - - -
- - - - - - - - -
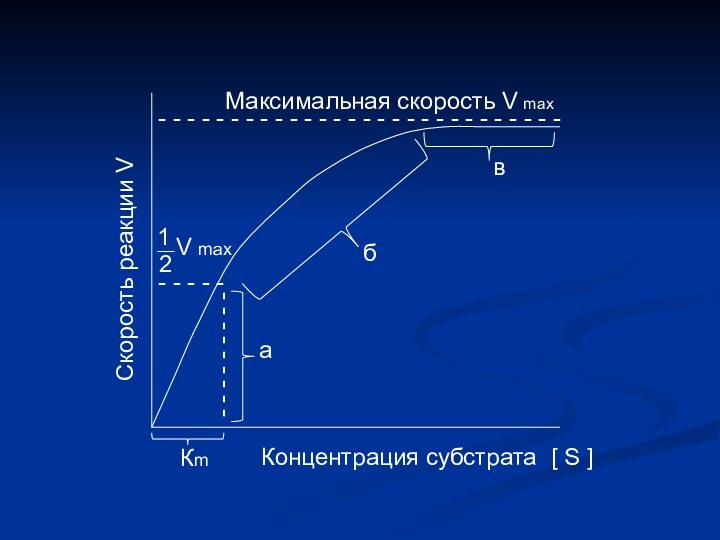
- - - - - - - - - - - - -Максимальная скорость V max
- - - - -
- - - - - - - - -
1
2
V max
а
б
в
Кm
Концентрация субстрата
[ S ]
Скорость реакции V
Слайд 11 - - - - - - -
- - - - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
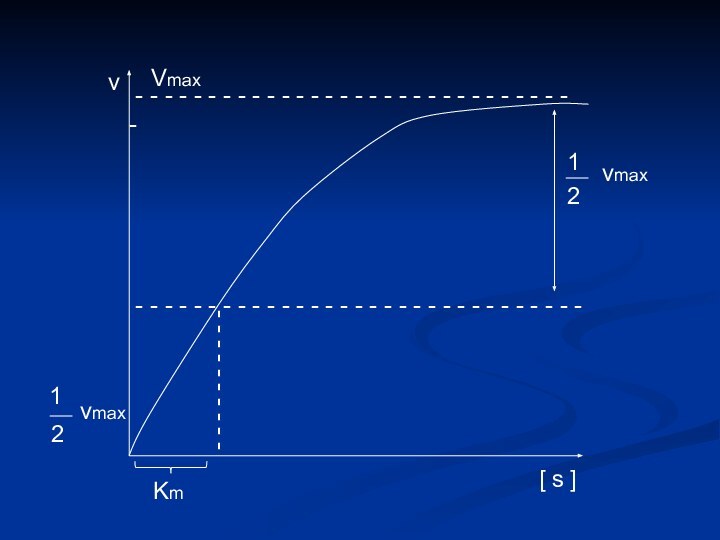
[ s ]
v
1
2
vmax
Vmax
1
2
vmax
Km
Слайд 12
Определение численного значения Кm
Если v =
½ vmax
V max
2
=
V max
.
[ s
] Кm + [ s ]
1
2
=
s
Km
+
[ s ]
или
Km
+ [ s ] = 2 [ s ]
Km = [ s ]
Слайд 16
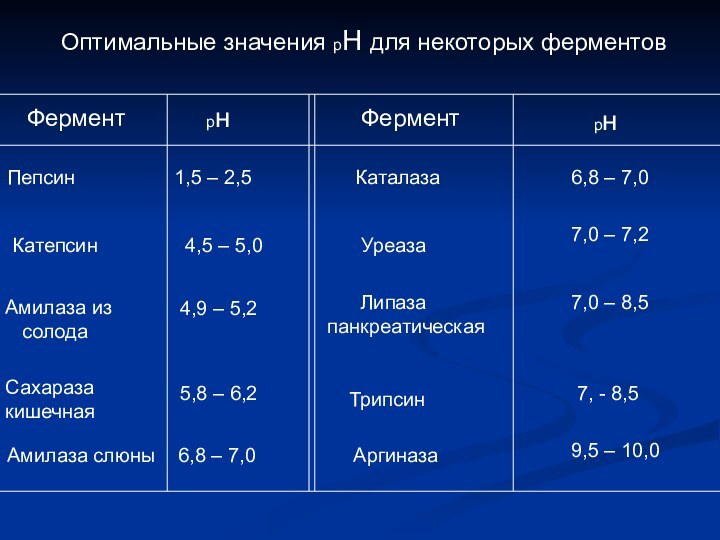
Оптимальные значения рН для некоторых ферментов
Фермент
рн
Фермент
рн
Пепсин
1,5 – 2,5
Каталаза
6,8
– 7,0
Катепсин
4,5 – 5,0
Уреаза
7,0 – 7,2
Амилаза
из солода
4,9 – 5,2
Липаза
панкреатическая
7,0 – 8,5
Сахараза
кишечная
5,8 – 6,2
Трипсин
7, - 8,5
Амилаза слюны
6,8 – 7,0
Аргиназа
9,5 – 10,0
Слайд 17
Торможение активности СДГ малоновой кислотой
+
+
ООС
ООС
С
С
Н
Н
Н
Н
- 2Н
ООС
СН
СН
ООС
;
+
+
ООС
ООС
СН
Блокиро-
вание
реакции
Сукцинат
Фумарат
Малонат
Слайд 20
- - - - - -
- -
- - - -
- - - -
- - - - - - - - - - - - - - - - - - - - - - - - - -1
2
V max
2
1
0
v
V max = v i
Km
Kmi
[ S ]
График зависимости скорости ферментативной реакции от
концентрации субстрата в присутствии конкурентного ингибитора
Слайд 21
- - - - - -
- -
- -
1
vmax
=
1
vi
1
Km
1
Kmi
-
1
v
2
1
[ S ]
1
-
График зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора.
Слайд 22
- - - - - -
- -
- - - -
- - - -
- - - - - - - - - - - - - - - - - - - - - 0
v
Km =
Kmi
[ S ]
- - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
1
2
Vmax
1
2
V i
2
1
V max
V i
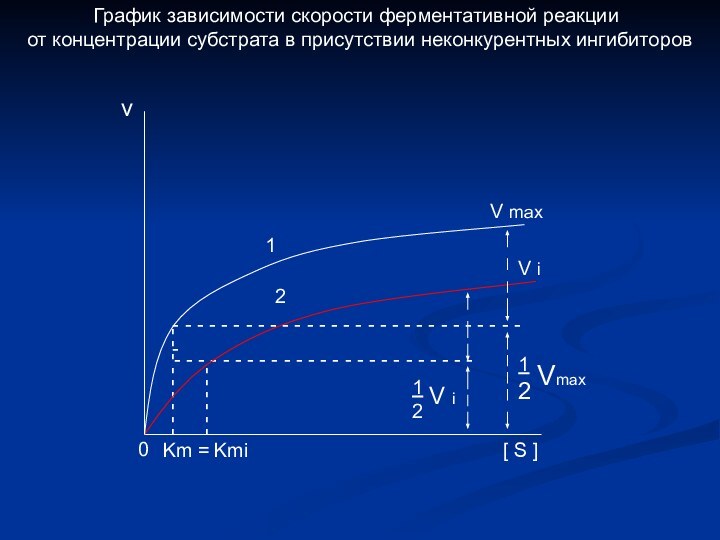
График зависимости скорости ферментативной реакции
от концентрации субстрата в присутствии неконкурентных ингибиторов





























