– это соединения, содержащие карбонильную
\группу С═О.
/
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




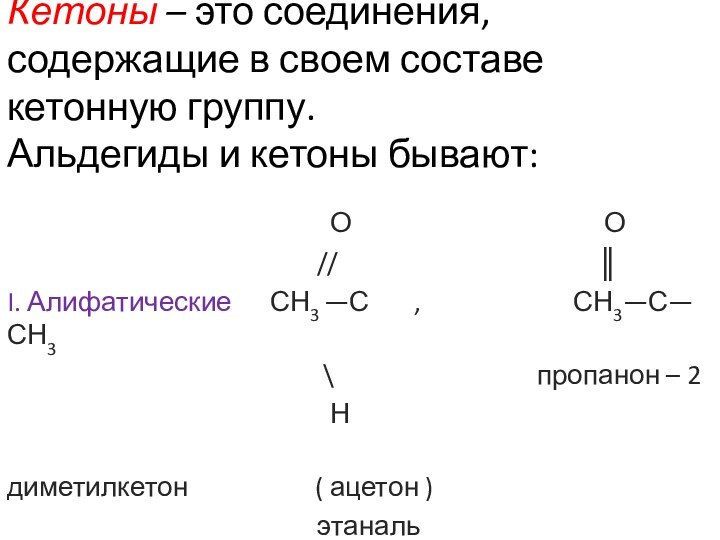
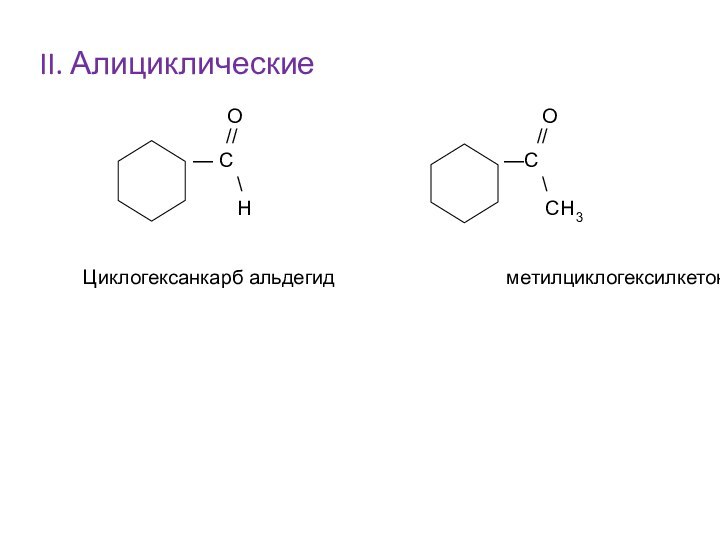
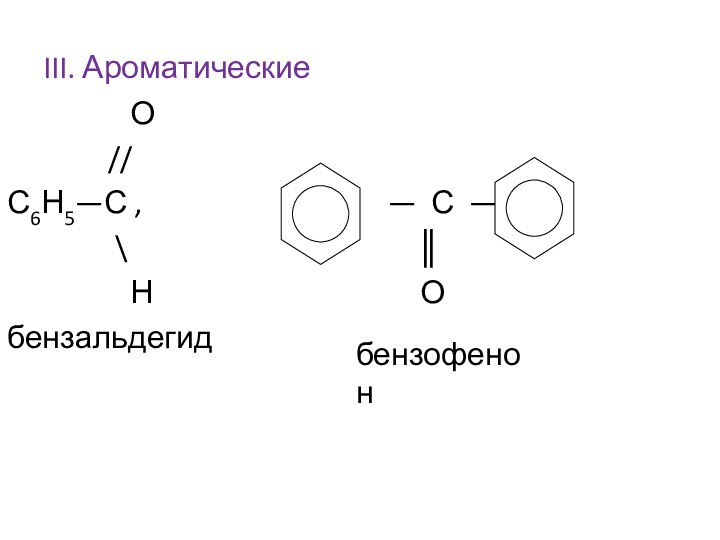
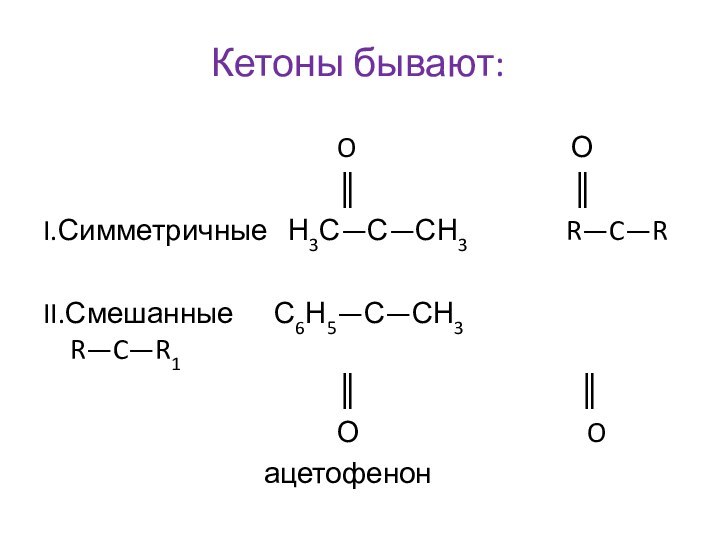
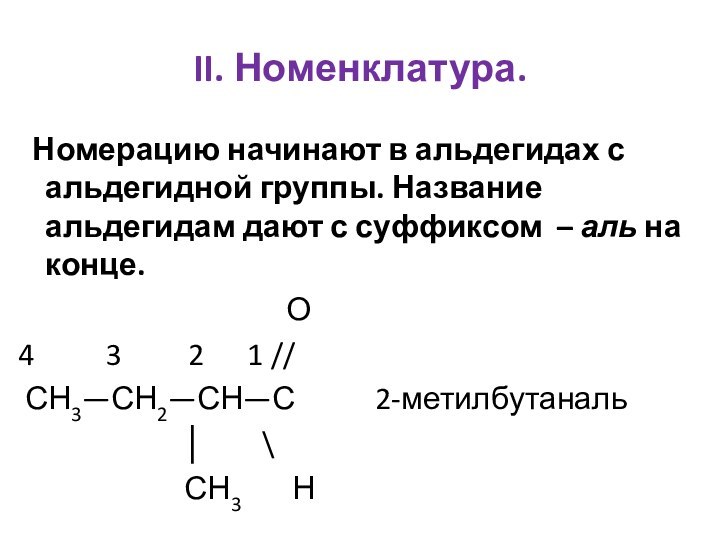
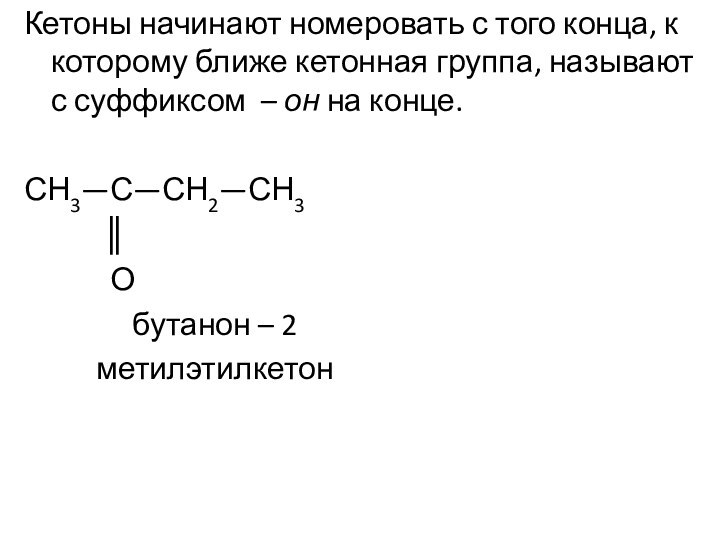
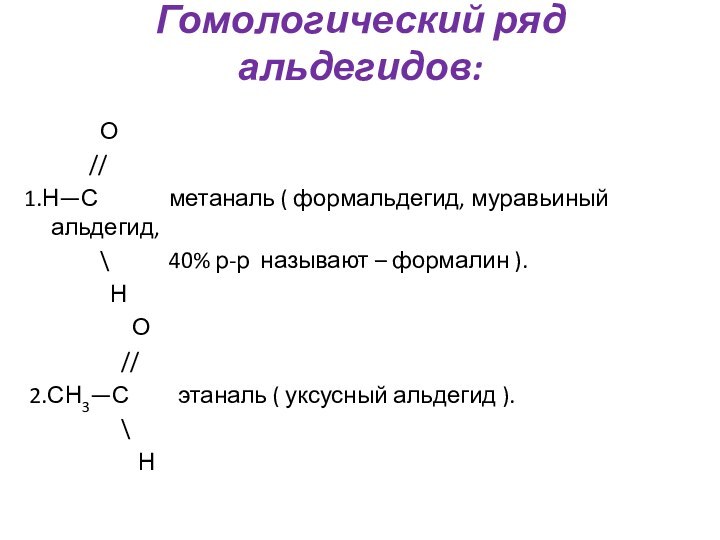
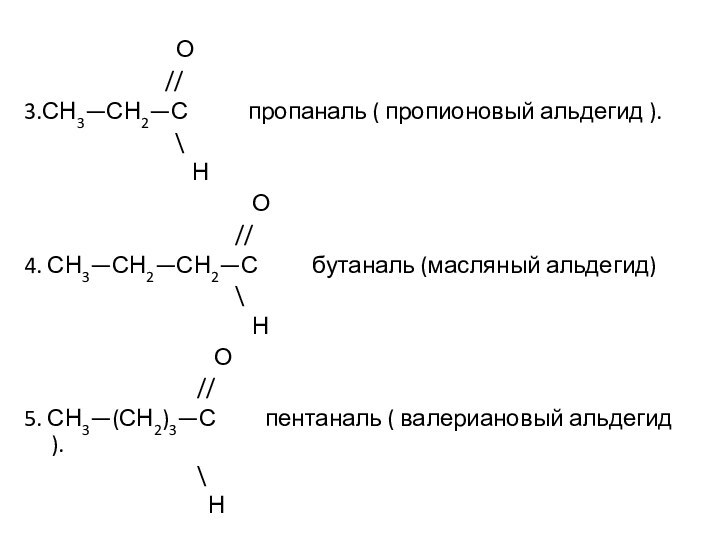
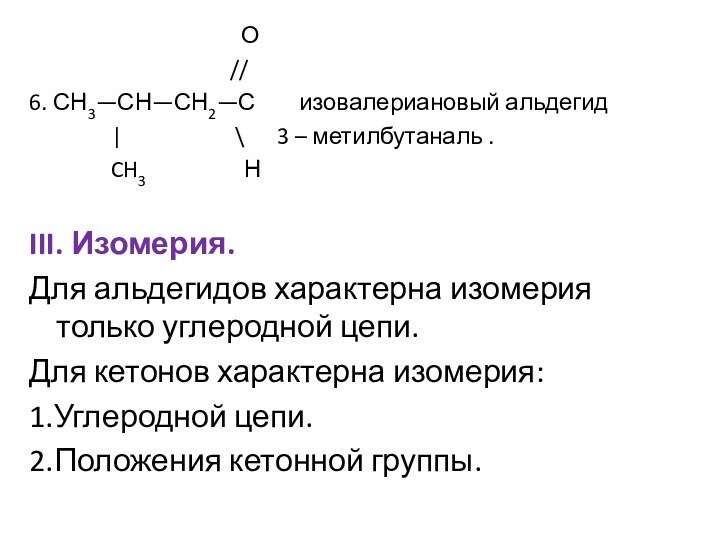
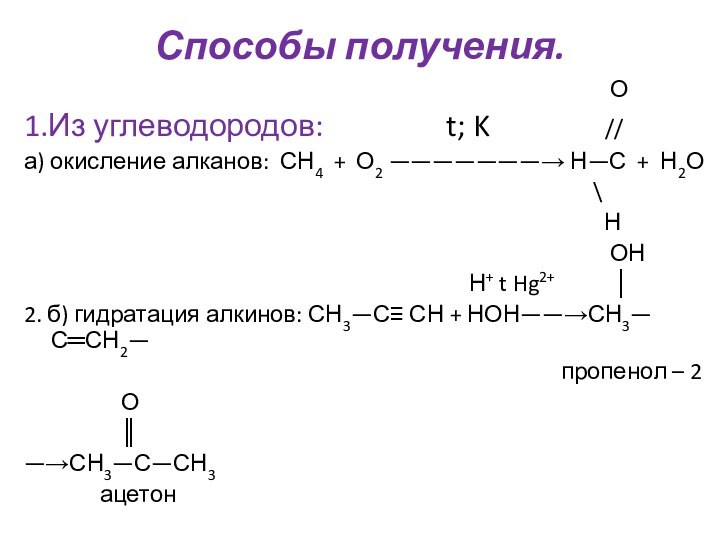
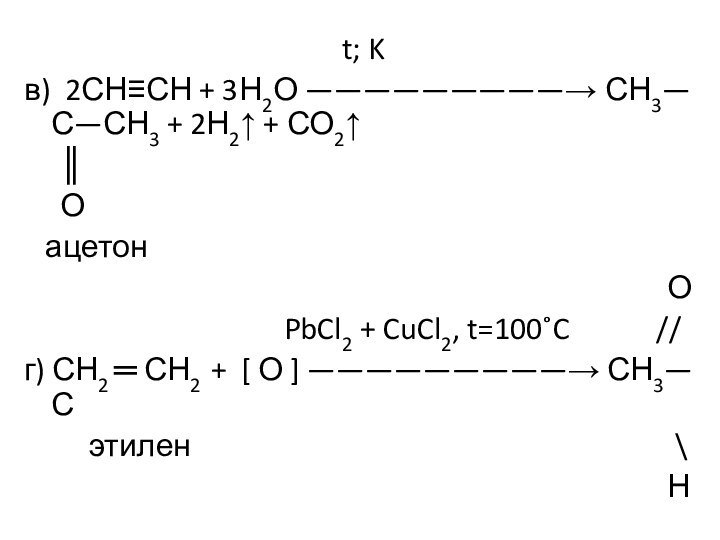
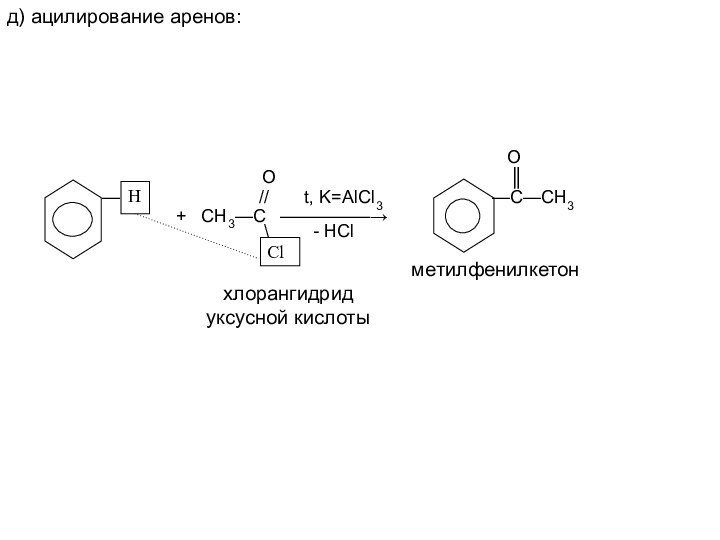
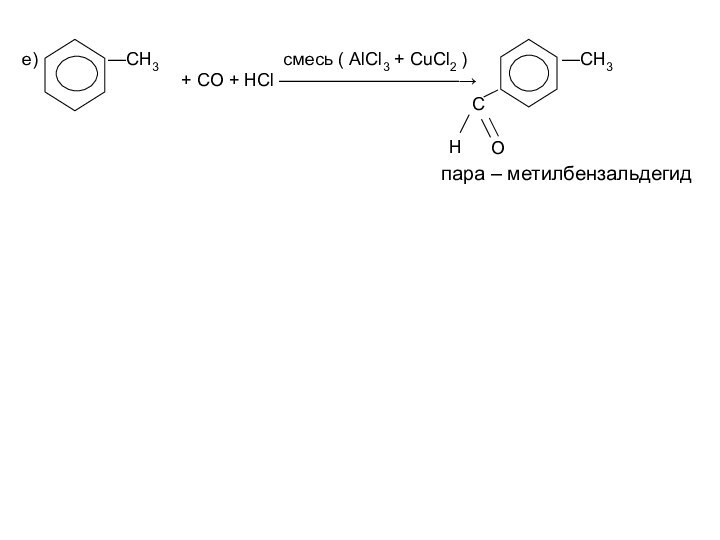



Им можно дать и такое определение: « Это соединения, содержащие карбонильную группу, связанную с атомом водорода и углеводородным радикалом».
O
//
R—C общая формула альдегидов.
\
H
\
Группу С ═ О называют также кетонной группой
/
О ║
— // t, K=AlCl3 —C—CH3
+ СН3—С —————→
\ - HCl
метилфенилкетон
хлорангидрид
уксусной кислоты
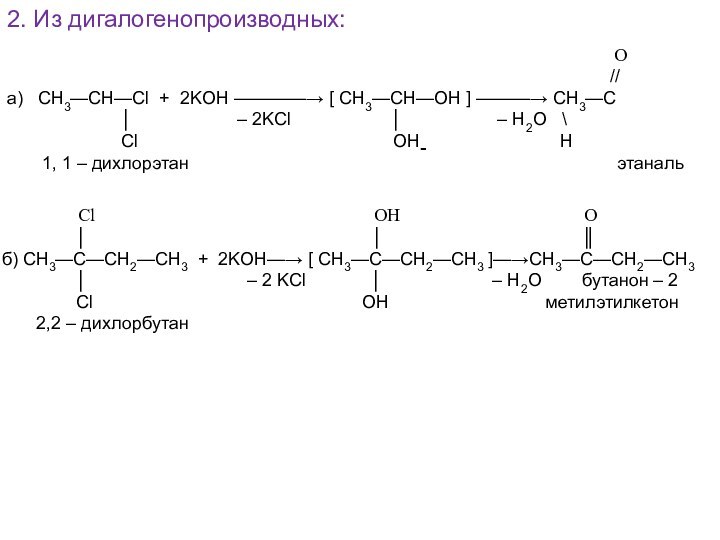
Cl OH O
│ │ ║
б) СН3—С—СН2—СН3 + 2KOH—→ [ CH3—C—CH2—CH3 ]—→CH3—C—CH2—CH3
│ – 2 KCl │ – H2O бутанон – 2
Cl OH метилэтилкетон
2,2 – дихлорбутан
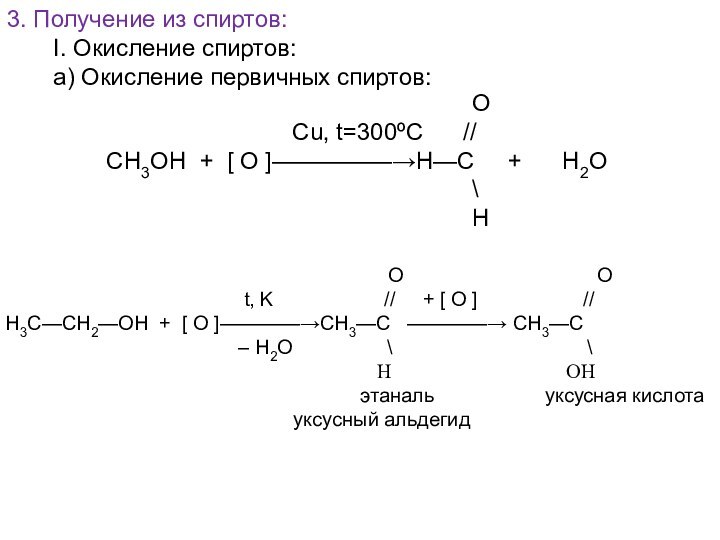
О
Cu, t=300ºC //
СН3ОН + [ О ]—————→Н—С + Н2О
\
Н
O O
t, K // + [ O ] //
H3C—CH2—OH + [ O ]————→CH3—C ————→ CH3—C
– H2O \ \
H OH
этаналь уксусная кислота
уксусный альдегид
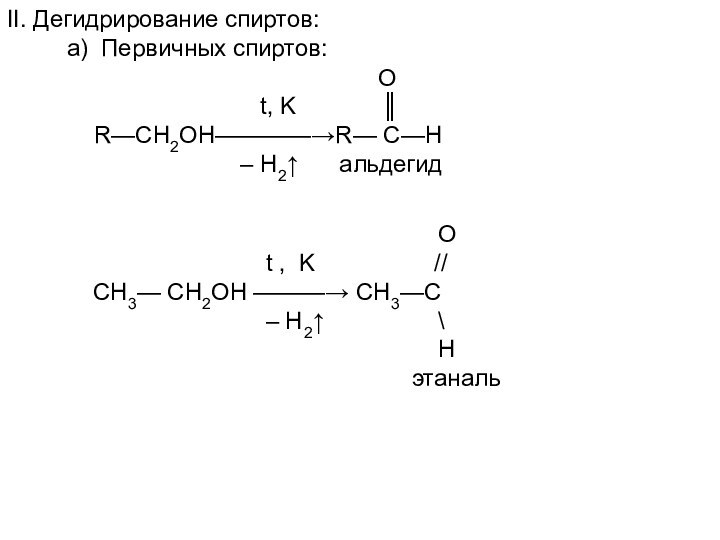
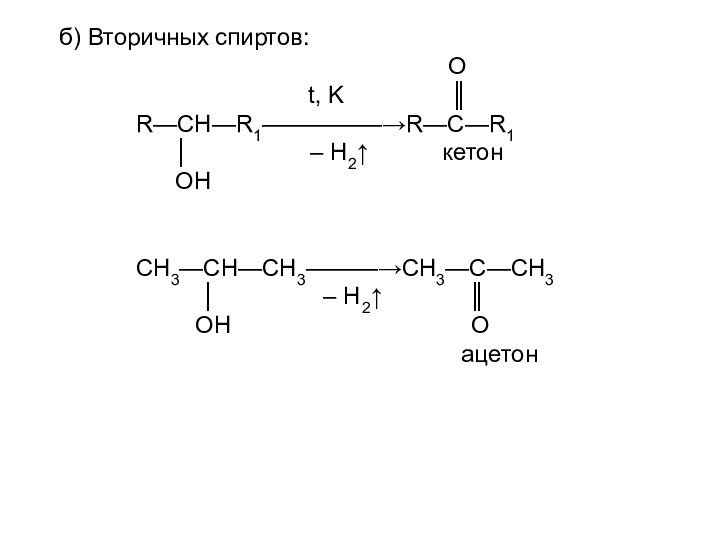
II. Дегидрирование спиртов:
а) Первичных спиртов:
O
t, K ║
R—CH2OH————→R— C—H
– H2↑ альдегид
t
СН3ОН + CuO ————→ Cu0 + H2O + H—C
\
H
метаналь
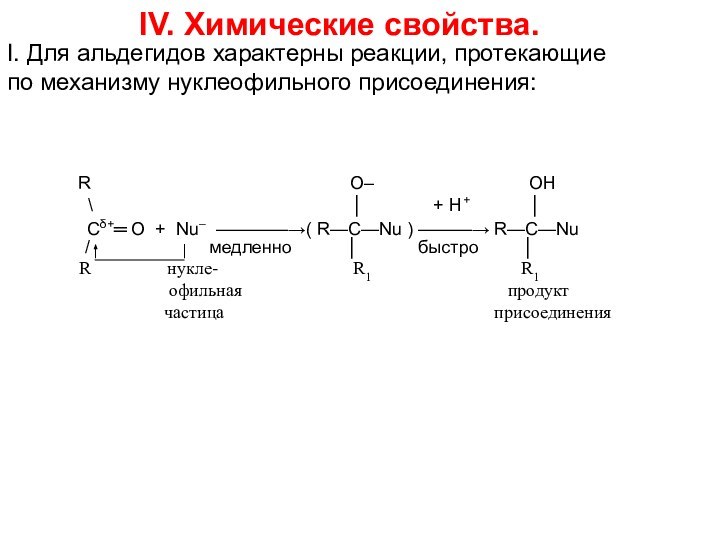
Cδ+═ O + Nu– ————→( R—C—Nu ) ———→ R—C—Nu
/ медленно │ быстро │
R нукле- R1 R1
офильная продукт
частица присоединения
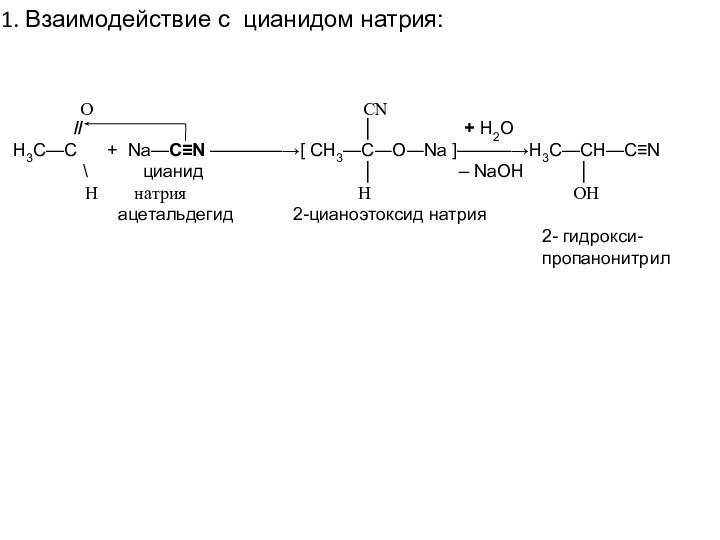
// │ + H2O
Н3С—С + Na—C≡N ————→[ CH3—C―O―Na ]———→H3C—CH—C≡N
\ цианид │ – NaOH │
Н натрия H OH
ацетальдегид 2-цианоэтоксид натрия
2- гидрокси-
пропанонитрил
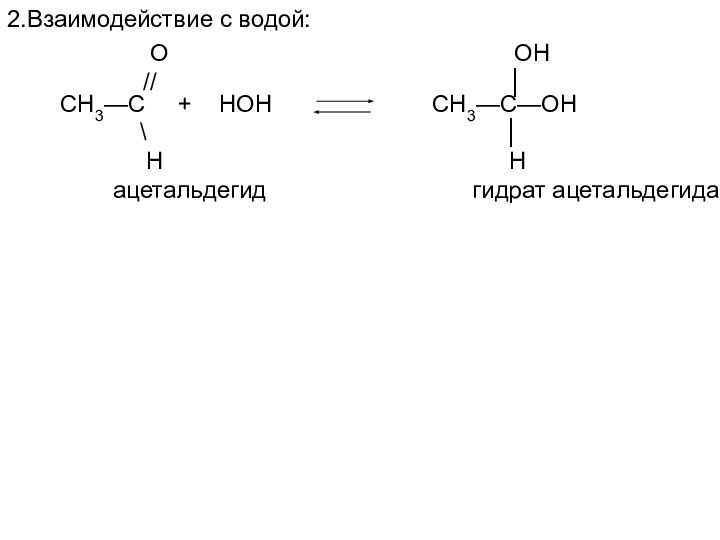
СН3—С + НОН СН3—С—ОН
\ │
Н Н
ацетальдегид гидрат ацетальдегида
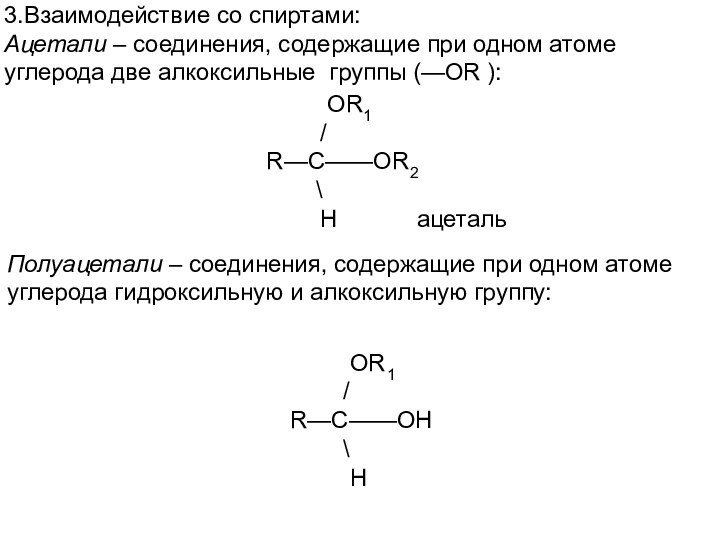
Полуацетали – соединения, содержащие при одном атоме
углерода гидроксильную и алкоксильную группу:
OR1
/
R—C——OH
\
H
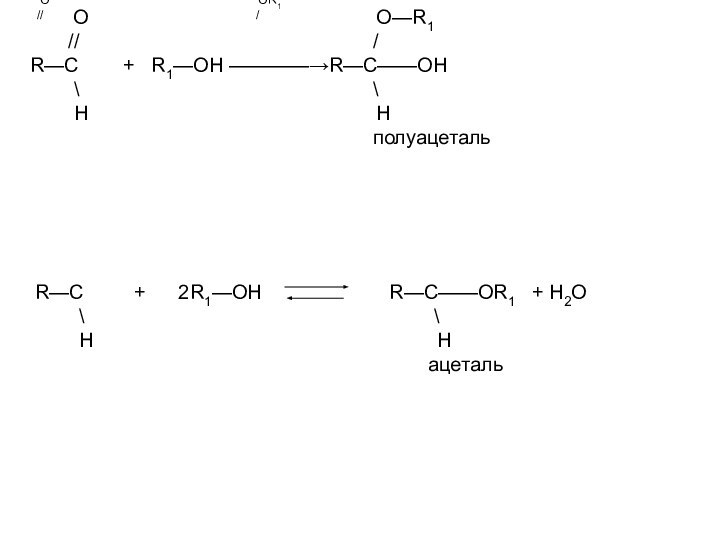
O OR1
// /
R—C + 2R1—OH R—C——OR1 + H2O
\ \
H H
ацеталь
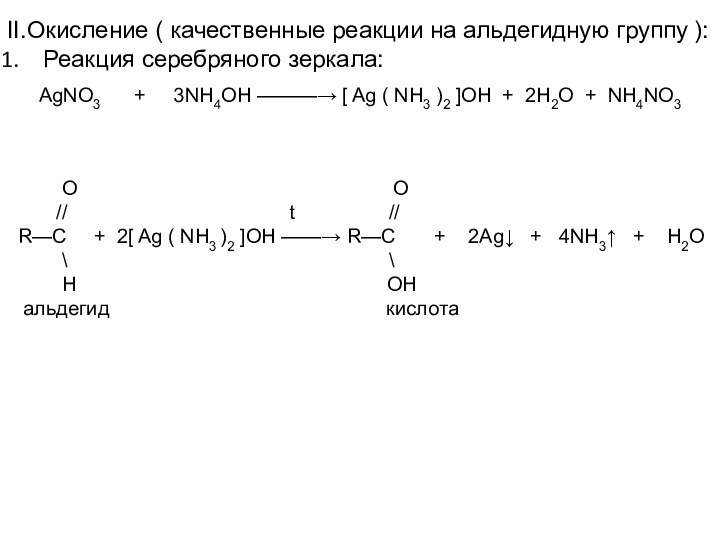
O O
// t //
R—C + 2[ Ag ( NH3 )2 ]OH ——→ R—C + 2Ag↓ + 4NH3↑ + H2O
\ \
H OH
альдегид кислота
O O
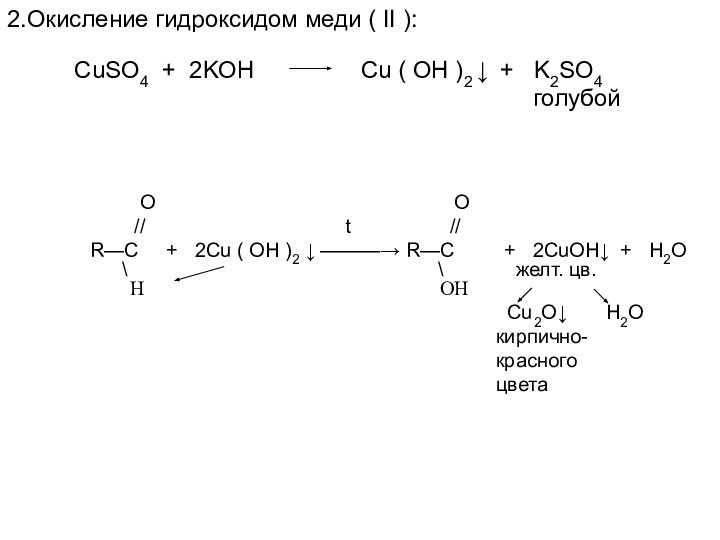
// t //
R—C + 2Cu ( OH )2 ↓ ———→ R—C + 2CuOH↓ + H2O
\ \ желт. цв.
H OH
Сu2O↓ H2O
кирпично-
красного
цвета
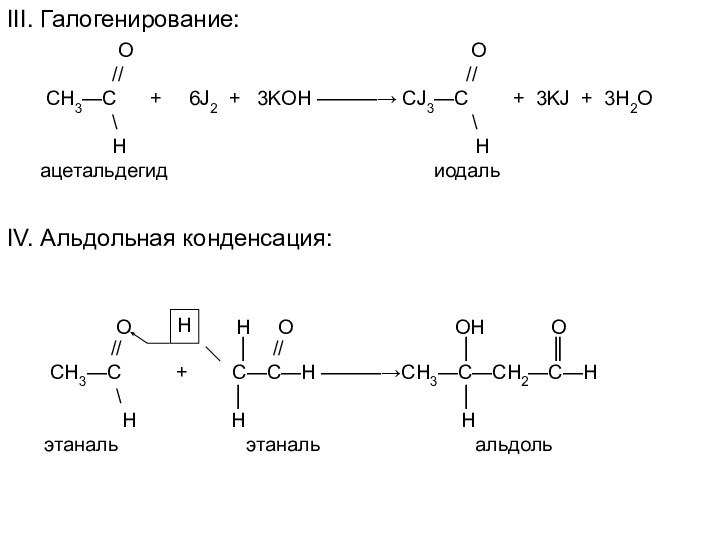
IV. Альдольная конденсация:
О Н О ОН О
// │ // │ ║
СН3—С + С—С—Н ———→СН3—С—СН2—С—Н
\ │ │
Н Н Н
этаналь этаналь альдоль
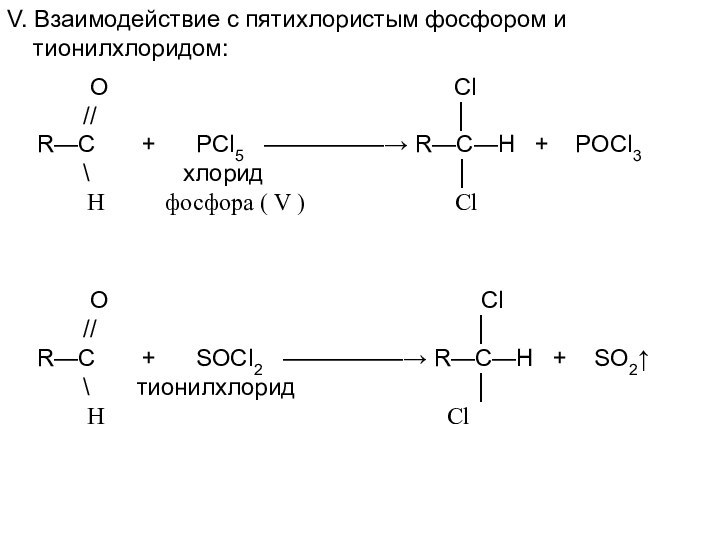
Н
O Cl
// │
R—C + SOCl2 —————→ R—C—H + SO2↑
\ тионилхлорид │
H Cl
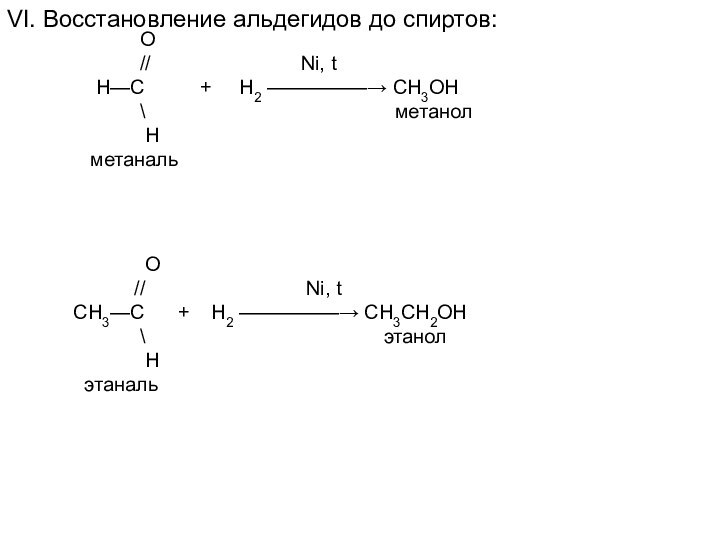
O
// Ni, t
СH3—C + H2 —————→ CH3СH2ОН
\ этанол
H
этаналь
О
//
2. Этаналь СН3—С . Подвижная, бесцветная, легкоиспаряющаяся жидкость с характер-
\ ным запахом. Используют для получения уксусной кислоты, раст-
Н ворима в воде.
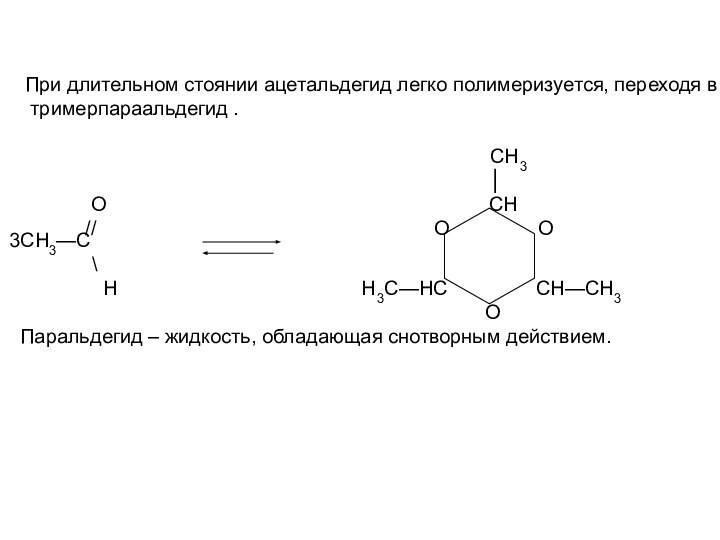
О СН
// О О
3СН3—С
\
Н Н3С—НС СН—СН3
О
Паральдегид – жидкость, обладающая снотворным действием.
О
//
4. Бензальдегид С6Н5—С . Жидкость с характерным запахом ( запахом горького минда-
\ ля ), бесцветная, маслянистая. Используют для получения
Н красителей , душистых и лекарственных веществ.
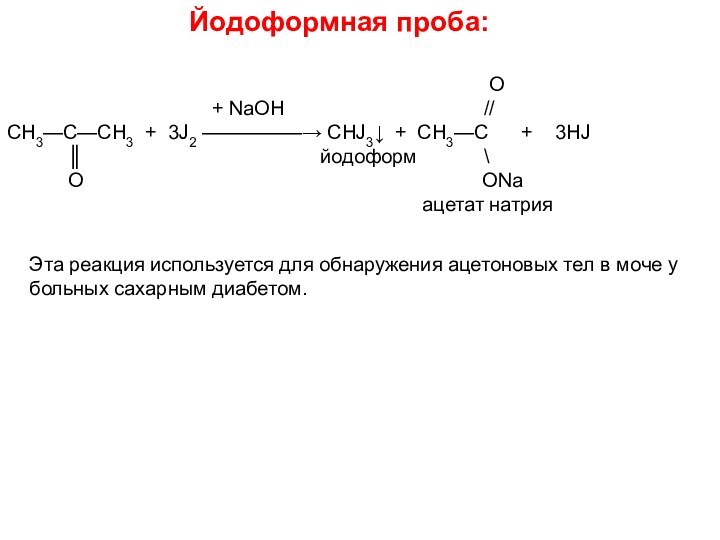
5. Пропанон ( ацетон ) – бесцветная жидкость, с характерным запахом, легче воды,
растворитель. Используется для синтеза хлороформа, встречается в моче больных
сахарным диабетом. Хорошо растворим в воде, спирте и эфире.