Слайд 2
Введение
Коллоидная химия – это наука о дисперсных системах
и поверхностных явлениях. Она изучает физико-химические свойства высокодисперсных систем
и растворов высокомолекулярных соединений.
Дисперсная система (ДС) – это система, в которой хотя бы одно вещество находится в диспергированном (раздробленном) состоянии.
Дисперсная фаза (ДФ)– это то, что находится в диспергированном состоянии.
Дисперсионная среда – это сплошная однородная среда, в объеме которой распределена дисперсная фаза.
Слайд 3
Для ДС характерно:
наличие высокоразвитой поверхности частиц ДФ, что
является причиной появления в ДС избыточной свободной поверхностной энергии
(ΔGs) и связанной с ней различных поверхностных явлений;
2) возникновение в ДС размерных ( масштабных) эффектов, которые проявляются в виде значительного отличия их свойств от подобных свойств макроскопических тел.
Слайд 6
6 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Поверхностные явления – это физико-химические явления,
которые обусловлены особыми (по сравнению с объемными) свойствами поверхностных
слоев жидкостей и твердых тел.
6.1 Поверхностная энергия дисперсных систем
Слайд 7
Объединенное уравнение первого и второго законов термодинамики для
поверхности
При постоянстве температуры, давления, величины заряда поверхности и число молей адсорбированного вещества поверхностное натяжение σ представляет собой удельную свободную поверхностную энергию.
Слайд 8
На величину σ влияют:
химическая природа веществ.
температура
природа граничащих фаз σ12 = σ1 - σ2
кривизна поверхности жидкости σr = Kr
наличие примесей
заряд поверхности
Слайд 9
6.2 Классификация поверхностных явлений
А. Для самопроизвольных поверхностных явлений
ΔGs< 0
ΔGs = σ·Δs
За счет уменьшения σ происходят
поверхностные явления:
адсорбция;
адгезия (прилипание);
смачивание;
4) гетерогенное образование зародышей новой фазы;
5) коагуляция;
6) электроповерхностные явления;
7) образование различной огранки кристаллов.
Слайд 10
2. За счет уменьшения площади поверхности (∆s
явления;
коалесценция;
спекание частиц ДФ в порошках;
собирательная рекристаллизация;
изотермическая перегонка.
Б.
Для несамопроизвольных поверхностных явлений ΔGs>0.
Закономерности их изучает физико-химическая механика.
эффект Ребиндера;
эффект Иоффе;
механохимические реакции .
Литература: Химическая энциклопедия. т.3, с.590, 1992.
Слайд 11
6.3 Адсорбция
Основные понятия: сорбция, адсорбция, адсорбент, адсорбат, адсорбтив,
абсорбция, хемосорбция.
Силы, вызывающие адсорбцию:
межмолекулярные силы (силы ван-дер-ваальса):
- ориентационные, индукционные, дисперсионные;
2) образование водородной связи;
3) образование химической связи.
Особенности адсорбционных процессов:
самопроизвольность (ΔG < 0);
экзотермичность (ΔH < 0);
обратимость; процесс обратный адсорбции называется десорбцией;
высокая скорость из-за низкой энергии активации;
специфичность (избирательность).
Слайд 12
Классификация адсорбции по природе граничащих фаз:
на границе «газ-жидкость»;
на
границе «газ-твердое тело»;
на границе «жидкость-твердое тело».
Параметры адсорбции:
абсолютная адсорбция (А)
удельная
адсорбция (а)
избыточная (гиббсовская адсорбция)
Г = Сп – Сф [Г] =
Слайд 13
Количественное описание адсорбции.
Изотерма адсорбции
Уравнение изотермы адсорбции – это
уравнение, которое описывает изотерму адсорбции
Слайд 17
6.3.1 Адсорбция на границе «газ-твердое тело»
Мономолекулярная адсорбция.
Полимолекулярная
адсорбция.
Слайд 18
Теория БЭТ (авторы С.Брунауэр, П.Эммет и Е.Теллер)
Слайд 19
6.3.3 Адсорбция на границе «жидкость-твердое тело»
Различают 2 вида
адсорбции:
молекулярная – адсорбатом являются молекулы неэлектролита и растворителя;
ионная –
адсорбатом является один из ионов раствора электролита.
Молекулярная адсорбция.
На активных центрах преимущественно адсорбируется тот компонент раствора, у которого теплота смачивания поверхности адсорбента выше.
Ионная адсорбция:
эквивалентная адсорбция;
обменная адсорбция;
специфическая адсорбция.
Слайд 20
Уравнение Никольского:
Катионит (КУ-1… КУ-9 и другие)
пCaSO4 + R
(SO3H)2п → пH2SO4 + R (SO3)2пCaп
Анионит (АВ-15 … АВ-20
и другие)
nH2SO4 + R(NH3+OH-)2n →R(NH3+)2n(SO42-)n + 2nH2O
Слайд 21
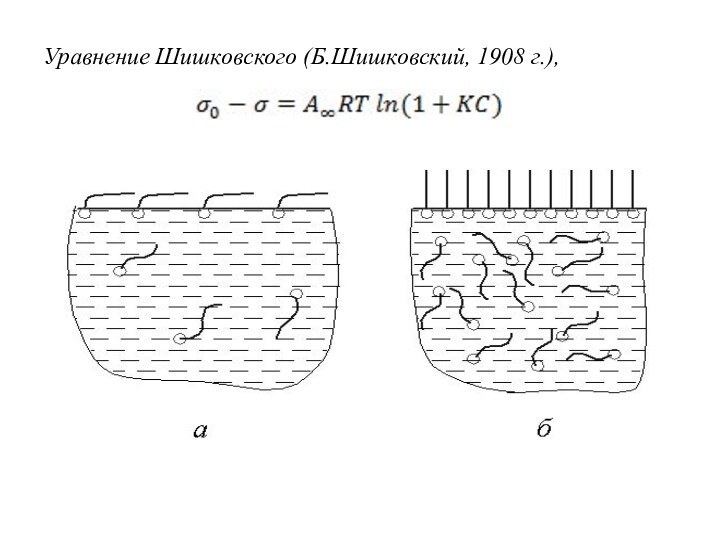
6.3.2 Адсорбция на границе «газ-жидкость»
Правило Дюкло-Траубе (Д.Дюкло, 1878
г; И.Траубе, 1884 г):
при удлинении углеводородного радикала ПАВ
на СН2-группу поверхностная активность q увеличивается в 3…3,5раза.