классификации неорганических веществ и самостоятельному применению знаний в сходной
и новой ситуациях.Дидактическая цель:
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





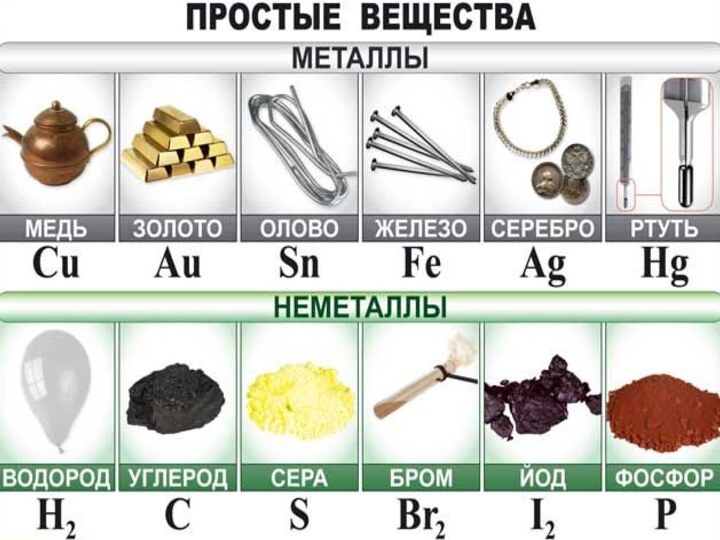
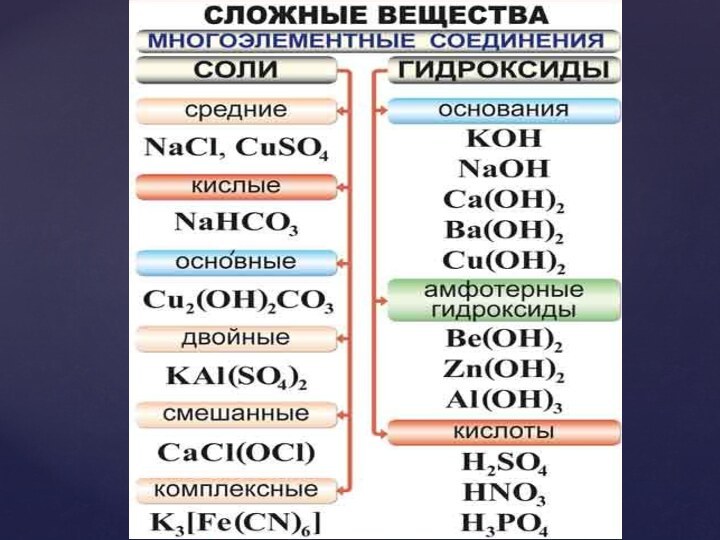
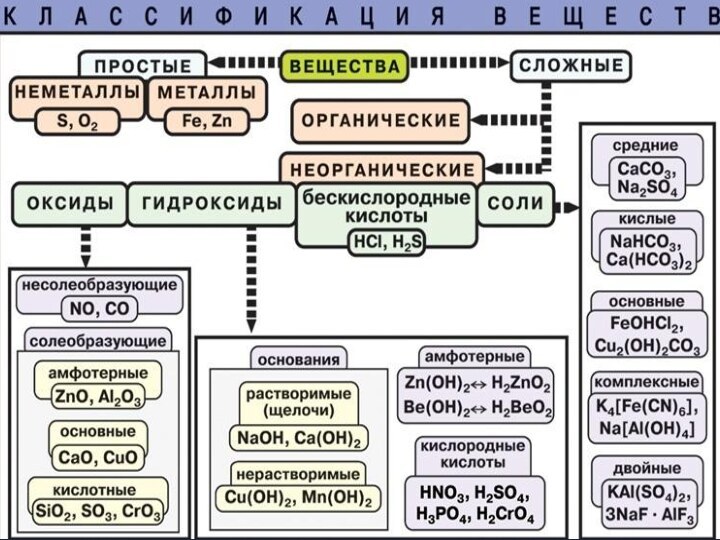

























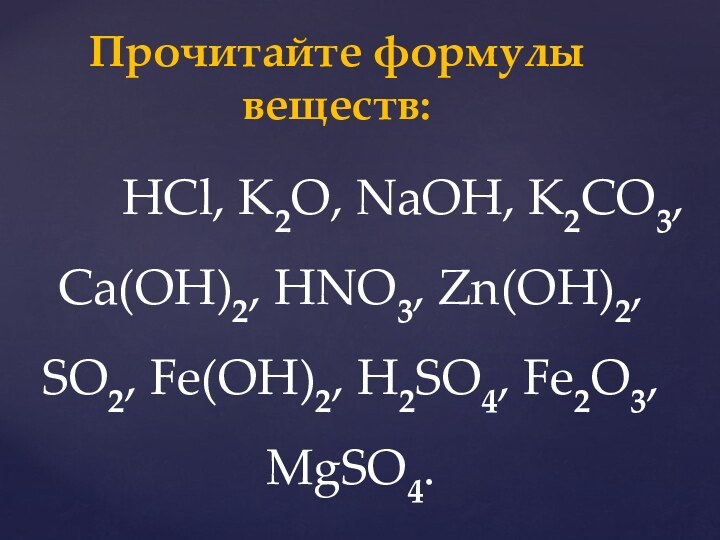




Дидактическая цель:
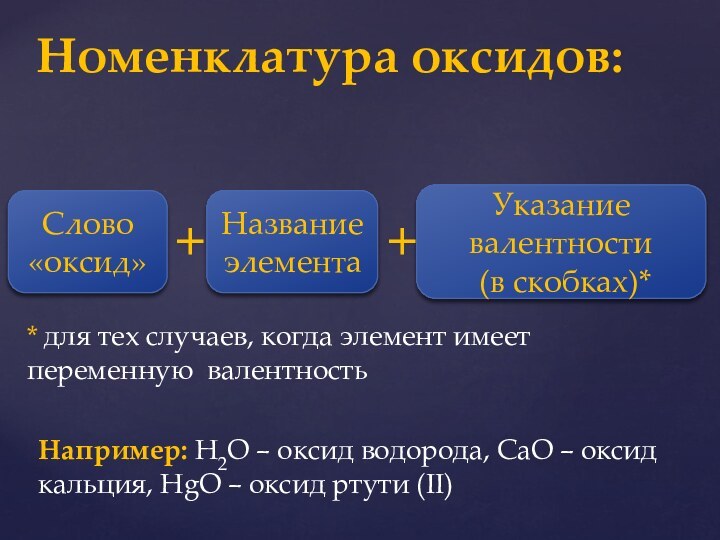
Оксиды-
Типы оксидов:
Составьте формулы и определите тип оксида:
Лабораторный опыт: «Химические свойства основных оксидов»
Лабораторный опыт: «Химические свойства кислотных оксидов»
Домашнее задание:
Продолжите предложение:
Верно ли утверждение, что:
(физкультминутка)
Верно ли утверждение, что:
Укажите лишнее:
Укажите лишнее:
Составьте формулы веществ: