- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Металлы в годы войны 9 класс
Содержание
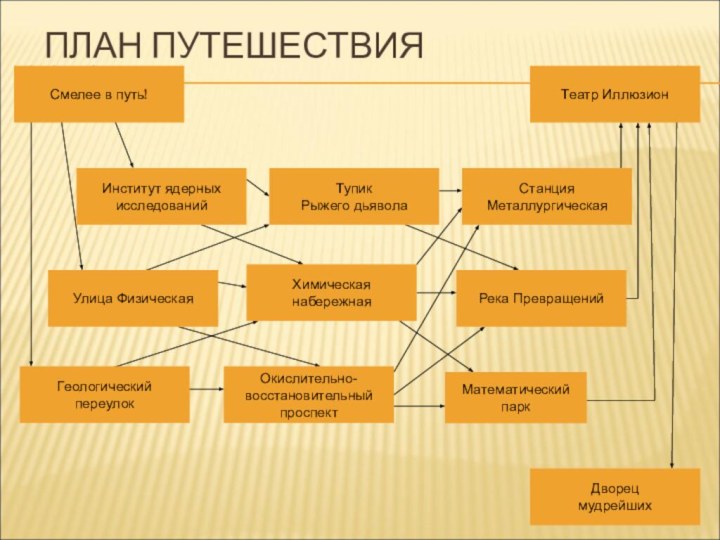
- 2. Смелее в путь!Институт ядерныхисследованийГеологическийпереулокУлица ФизическаяТупикРыжего дьяволаХимическаянабережнаяРека ПревращенийСтанцияМеталлургическаяТеатр ИллюзионОкислительно-восстановительныйпроспектМатематическийпаркДворецмудрейшихПЛАН ПУТЕШЕСТВИЯ
- 3. Предварительное заданиеВычислить степень окисления хрома в K2Cr2O7Ответ.
- 4. Сравнить строение атомов кальция и магния. У
- 5. Перечислите основные физические свойства металлов. Назовите самый
- 6. В каком виде металлы встречаются в природе?
- 7. 1. Почему коррозию часто называют «рыжим дьяволом»?
- 8. 2. Назовите способы защиты от коррозии.
- 9. 3. Какое изделие из железа прослужит дольше:
- 10. С какими из перечисленных веществ: H2O, Fe,
- 11. Расставить коэффициенты в уравнениях реакций методом электронного
- 12. 1. Как из Cu2O получить медь?2. Как
- 13. Записать уравнения химических реакций по схемам:Mg →
- 14. Решите задачи.Вычислить массу NaCl, которую можно получить
- 15. Из имеющихся растворов реактивов FeCl3, CuSO4,
- 16. Записать уравнения реакций в кратком ионном
- 18. ЦЕЛЬ УРОКА : ИЗУЧЕНИЕ РОЛИ МЕТАЛЛОВ
- 19. ЖЕЛЕЗО
- 20. БОЛЕЕ 90% ВСЕХ МЕТАЛЛОВ, КОТОРЫЕ ИСПОЛЬЗОВАЛИСЬ В
- 21. СВИНЕЦ82Pb
- 22. НИКЕЛЬБез никеля нет брони.Без брони нет танков.
- 23. АЛЮМИНИЙ «Крылатый металл»: легкий, пластичный,
- 24. Порошок Al в зажигательных бомбахЛенты из Al
- 25. МЕДЬ Сплав Cu c Sn – пушечный металл 29Cu
- 26. сплав Cu с Zn – латунь - гильзы и арт. снаряды
- 27. СЕРЕБРО Антимикробный эффект - для лечения свищей,
- 28. МАГНИЙПожарно-сторожевая охрана зданий Химизм «зажигалок»:При взрыве бомбы4Al
- 30. СТАЛИ – СПЛАВЫ ЖЕЛЕЗА С ДРУГИМИ МЕТАЛЛАМИ,
- 32. СПЛАВ CU, SN И
- 33. УРАН И ПЛУТОНИЙ6 августа 1945г. сброшена на
- 34. У ВОЙНЫ НЕПРИГЛЯДНОЕ ЛИЦОКартины Сталинграда, новой войны
- 35. МЕТАЛЛУРГИЯ В ГОДЫ ВОЙНЫУрал - стержень
- 36. Все артиллерийские орудия производил Мотовилихинский завод.Он дал
- 37. П А М Я Т ЬМонумент "Героям фронта и тыла" Памятник Скорбящей матери
- 38. СПАСИБО ЗА ВНИМАНИЕ!
- 39. Скачать презентацию
- 40. Похожие презентации






































Слайд 2
Смелее в путь!
Институт ядерных
исследований
Геологический
переулок
Улица Физическая
Тупик
Рыжего дьявола
Химическая
набережная
Река Превращений
Станция
Металлургическая
Театр Иллюзион
Окислительно-
восстановительный
проспект
Математический
парк
Дворец
мудрейших
ПЛАН
ПУТЕШЕСТВИЯ
Слайд 3
Предварительное задание
Вычислить степень окисления хрома в K2Cr2O7
Ответ. +6
Фото
с сайта http://chemistry-chemists.com
Вычислить степень окисления
марганца в KMnO4
Ответ. +7
План
путешествия
Слайд 4 Сравнить строение атомов кальция и магния. У какого
элемента сильнее выражены восстановительные свойства?
«Институт ядерных исследований»
Ответ. Химические элементы
кальций и магний расположены во второй группе периодической системы Д.И.Менделеева, поэтому на внешнем электронном слое имеют по 2 электрона. Магний расположен в 3-м периоде, а кальций – в 4-м, радиус атома кальция больше, чем радиус атома магния, а значит и восстановительные свойства кальция выражены сильнее. Фото с сайта http://nucloserv.jinr.ru
План
путешествия
Слайд 5 Перечислите основные физические свойства металлов. Назовите самый пластичный
и самый электропроводный металл.
«Улица Физическая»
Ответ. Металлы обладают пластичностью (ковкостью),
тепло- и электропроводностью, имеют металлический блеск. Самый пластичный металл – золото, самый электропроводный металл – серебро.План
путешествия
Слайд 6 В каком виде металлы встречаются в природе? Назовите
самородные металлы. Почему щелочные металлы не встречаются в природе
в свободном виде?«Геологический переулок»
Ответ. Металлы в природе находятся в виде руд, в водных растворах – в виде солей, а также в самородном виде. В самородном виде встречаются золото, серебро, платина, ртуть. Щелочные металлы имеют высокую химическую активность, реагируют с кислородом воздуха и водой при обычных условиях, поэтому они не могут в природе встречаться в свободном виде.
План
путешествия
Слайд 7 1. Почему коррозию часто называют «рыжим дьяволом»? Какой
вред она приносит?
«Тупик Рыжего дьявола»
Ответ. Продукты коррозии железа имеют
красно-коричневый цвет, а вред, приносимый этим процессом, поистине дьявольский, поэтому коррозию и называют «рыжим дьяволом». Ежегодно из-за коррозии теряется около четверти всего производимого в мире железа. Замена и ремонт деталей судов, автомобилей, приборов и коммуникаций требует экономических затрат. Коррозия вызывает серьезные экологические последствия. Например, утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды.Слайд 8 2. Назовите способы защиты от коррозии. (4
способа.)
«Тупик Рыжего дьявола»
Ответ. Нанесение защитных покрытий (металлических и
неметаллических); использование материалов и сплавов, устойчивых к коррозии; протекторная защита (создание контакта с более активным металлом); использование специальных веществ – ингибиторов коррозии.Слайд 9 3. Какое изделие из железа прослужит дольше: оцинкованное
или луженое (покрытое оловом)? Объясните, почему?
«Тупик Рыжего дьявола»
Ответ. Оцинкованное
изделие прослужит дольше, т.к. цинк более активный металл по сравнению с железом, – в случае нарушения защитного слоя будет разрушаться именно цинк, сохраняя изделие. Внешний вид изделия ухудшится, но оно останется целым. При нарушении защитного слоя луженого изделия, разрушаться будет железо, т.к. его химическая активность выше, чем у олова. Изделие сохранит красивый внешний вид, но быстро прохудится – в нём образуется дыра.План
путешествия
Слайд 10 С какими из перечисленных веществ: H2O, Fe, Cl2,
KOH, CuO, HCl(г.), K будут реагировать при обычных условиях все
три вещества:барий, кальций, магний?
«Химическая набережная»
Ответ. H2O, Cl2, HCl(г.).
При обычных условиях все три металла будут медленно реагировать с хлором и хлороводородом; Ca и Ba будут реагировать с водой (магнию для этого нужно зажечься!).
План
путешествия
Слайд 11
Расставить коэффициенты в уравнениях реакций методом электронного баланса:
1)
Ca + O2 →
2) Mg + N2 →
3) Al
+ Cl2 →«Окислительно-восстановительный проспект»
Ответ.
План
путешествия
Слайд 12
1. Как из Cu2O получить медь?
2. Как из
Fe3O4 получить железо?
3. Как из ZnO получить цинк?
Записать
уравнения реакций.«Станция Металлургическая»
Ответ.
1) Cu2O + H2 = 2Cu + H2O
2) Fe3O4 + 4H2 = 3Fe + 4H2O
3) 3ZnO + 2Al = 3Zn + Al2О3
Можно использовать ещё
углерод и угарный газ.
План
путешествия
Слайд 13
Записать уравнения химических реакций по схемам:
Mg → MgO
→ Mg(NO3)2 → Mg(OH)2
Ca → CaO → CaCl2 →
CaCO3Al → Al2O3 → AlCl3 → Al(OH)3
«Река Превращений»
Ответ.
1) 2Mg + O2 = 2MgO
MgO + 2HNO3 = Mg(NO3)2 + H2O
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
2) 2Ca + O2 = 2CaO
CaO + 2HCl = CaCl2 + H2O
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
3) 4Al + 3O2 = 2Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
План
путешествия
Слайд 14
Решите задачи.
Вычислить массу NaCl, которую можно получить из
натрия массой 4,6 грамма.
«Математический парк»
Ответ.
2Na
+ Cl2 = 2NaClν(Na) = 4,6 (г) : 23 (г/моль) = 0,2 моль, ν(NaCl) = ν(Na) = 0,2 моль, m(NaCl) = 0,2 (моль) • 58,5 (г/моль) = 11,7 г
План
путешествия
Слайд 15 Из имеющихся растворов реактивов FeCl3, CuSO4, BaCl2, Na2CO3,
NaOH получите:
гидроксид железа(III);
гидроксид меди(II);
карбонат бария.
Запишите уравнения проведенных
реакций.«Театр Иллюзион»
Ответ.
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
План
путешествия
Слайд 16
Записать уравнения реакций в кратком ионном видах:
1)
Ba(OH)2 + HCl =
2) FeCl3 + KOH =
3) Al(OH)3
+ HCl =4) CaO + HCl =
5) KOH + H2SO4 =
«Дворец мудрейших»
6) CaCl2 + AgNO3 =
7) NaOH + HCl =
8) CuCl2 + KOH =
9) Ba(NO3)2 + Na2SO4 =
10) Mg(OH)2 + HNO3 =
Домашнее задание
Вычислить массу CaO, которую можно получить из кальция массой 8 граммов.
Вычислить массу MgS, которую можно получить из магния массой 4,8 грамма.
Слайд 18 ЦЕЛЬ УРОКА : ИЗУЧЕНИЕ РОЛИ МЕТАЛЛОВ В ОБЕСПЕЧЕНИИ
ПОБЕДЫ НАД ФАШИСТСКОЙ ГЕРМАНИЕЙ В ВЕЛИКОЙ ОТЕЧЕСТВЕННОЙ ВОЙНЕ
Металлов много
есть, но дело не в количестве: В команде работящей металлической Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало Заслуги безусловные металлов.
Слайд 19
ЖЕЛЕЗО
Пословицы:
“В бою железо дороже золота” (татарская).
“При рати железо дороже золота. Железом и золото добуду” (русская).
26
Fe
Слайд 20 БОЛЕЕ 90% ВСЕХ МЕТАЛЛОВ, КОТОРЫЕ ИСПОЛЬЗОВАЛИСЬ В ВОВ,
ПРИХОДИТСЯ
НА ЖЕЛЕЗО.
1000000 бомб сброшено фашистской авиацией на
Сталинград
Слайд 22
НИКЕЛЬ
Без никеля нет брони.
Без брони нет танков.
Без танков нет
победы.
Небольшой
вес,маневренность,
прочная и
неуязвимая броня.
28
Ni
Слайд 23
АЛЮМИНИЙ
«Крылатый металл»:
легкий, пластичный,
электро- и тепло-
проводный, хим. стойкий
Применение: обшивка самолетов, детали авиадвигателей, винтов, шасси и пр.
13
Al
Слайд 24
Порошок Al в зажигательных бомбах
Ленты из Al фольги
для защиты самолетов
(20 тысяч тонн сброшено на Германию)
Проволока
Al для заклепок на крыльях и фюзеляже самолетов(на одном истребителе их до миллиона)
Слайд 27
СЕРЕБРО
Антимикробный эффект - для лечения свищей, язв,
гнойных воспалений, ожогов
Серебро в сплавах с индием - для
изготовления прожекторов (противовоздушной обороны). 47
Ag
Слайд 28
МАГНИЙ
Пожарно-сторожевая охрана зданий
Химизм «зажигалок»:
При взрыве бомбы
4Al +
3O2 = 2Al2O3,
2Mg + O2 = 2MgO,
3Fe3O4 + 8Al
= 9Fe + 4Al2O3.Тушить водой нельзя
Mg+ 2Н2O = Mg(ОН)2 + Н2
12
Mg
Слайд 29
магнитные мины
ценнейший
стратегический - танковую броню, оболочку торпед и снарядов, детали самолетов и двигателей
27
Co
74
W
Слайд 30 СТАЛИ – СПЛАВЫ ЖЕЛЕЗА С ДРУГИМИ МЕТАЛЛАМИ, КОТОРЫЕ
ПРИДАЮТ СТАЛЯМ НОВЫЕ СВОЙСТВА
прочность, неуязвимость для снарядов - стволы орудий, автоматов, винтовок, ружей, детали самолетов, автомобили
42
Mo
Слайд 31
прочность,
легкость - солдатские каски, шлемы, броневые плиты на пушках, бронебойные снаряды
устойчивость к
коррозии - корпуса подводных лодок, детали корабельных двигателей, торпед, авиамоторов
23
V
24
Cr
Слайд 32 СПЛАВ CU, SN И ZN
- БРОНЗА ПАМЯТНИКИ
ВОИНАМПамятник погибшим в годы ВОВ (м/р Водники)
Памятник воину-
освободителю
(у Мотовил. завода)
Слайд 33
УРАН И ПЛУТОНИЙ
6 августа 1945г. сброшена на Хиросиму
первая урановая бомба (США);
9 августа 1945г. сброшена на Нагасаки
первая плутониевая бомба (США).Взрыв повлек за собой десятки тысяч смертей и сотни тысяч тяжелых увечий.
Последствия взрыва сказываются и сейчас на новых поколениях.
92
U
94
Pu
Слайд 34
У ВОЙНЫ НЕПРИГЛЯДНОЕ ЛИЦО
Картины Сталинграда, новой войны на
Донбассе…. Фашисты разрушили в СССР почти 32 тыс промышленных
предприятий , 4100 ж/д станций, 40 тыс больниц, 84 тыс образовательных учреждений, 43 тыс библиотек. Полностью разрушили и сожгли1710 городов и более 70 тыс сел и деревень
Слайд 35
МЕТАЛЛУРГИЯ
В ГОДЫ ВОЙНЫ
Урал - стержень военной экономики
в годы ВОВ:
производил 60% металла,
60% средних
и 100% тяжелых танков,сосредоточил более 1/3 советского машиностроения и
металлообработки.
Слайд 36
Все артиллерийские орудия производил Мотовилихинский завод.
Он дал фронту
48 600 артиллерийских систем.
Самое грозное оружие ВОВ –
«Катюши».Кировский завод поставлял фронту порох, заряды для реактивных установок.