Слайд 2
Фосфор в природе
В природе фосфор в свободном виде
не встречается – только в виде соединений. Важнейшими природными
соединениями фосфора являются минералы фосфориты и апатиты.
Основную их массу составляет фосфат кальция Са3 (РО4)3, из которого и получают в промышленности фосфор.
Слайд 3
Фосфор и его соединения
Фосфор Р +15)2е)8е)5е
15р,15е,16п степени окисл -3,0,+3,+5
( белый,
красный,
чёрный)
Решётки
(
молекулярная Р4,
атомная.
атомная.)
Слайд 4
Аллотропные модификации фосфора
Чёрный фосфор
Красный фосфор
Белый фосфор
Слайд 5
Кислотный оксид Р2О5
Физические свойства
Белое гигроскопичное порошкообразное вещество.
Хорошо
растворимое в воде, образует несколько кислот.
Используется как осушитель газов
и жидкостей, отнимает воду у химических соединений.
Слайд 6
Кислотный оксид Р2О5
Химические свойства
1) с водой
Р2О5 +
3 Н2О = 2Н3РО4
(ортофосфорная кислота)
Р2О5 + Н2О = 2НРО3
(метафосфорная кислота)
Р2О5 + 2 Н2О = Н4Р2О7
(пирофосфорная кислота)
Слайд 7
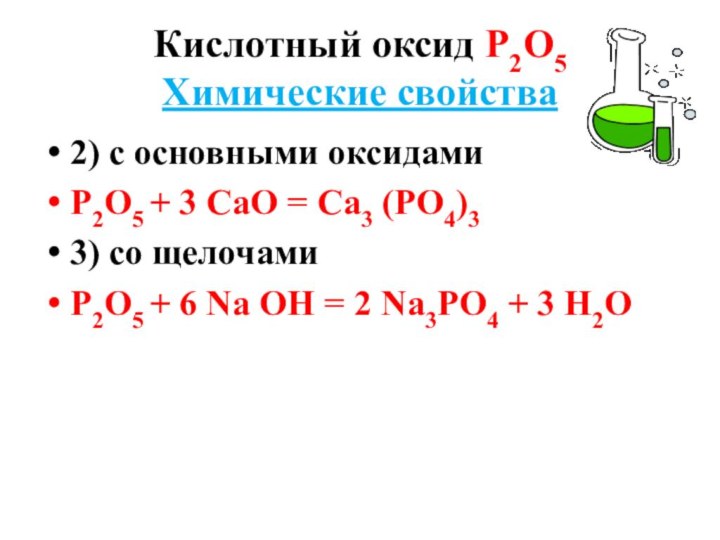
Кислотный оксид Р2О5
Химические свойства
2) с основными оксидами
Р2О5 +
3 СаО = Са3 (РО4)3
3) со щелочами
Р2О5 + 6
Nа ОН = 2 Nа3РО4 + 3 Н2О
Слайд 8
Ортофосфорная кислота Н3РО4
Физические свойства
Белые прозрачные кристаллы,
не ядовита
Кислота средней силы
С водой смешивается в любых соотношениях.
Тплав. = 42 0С, плавиться без разложения, при умеренном нагревании разлагается.
Окислительные свойства не проявляет (отличие от Н2SO4 (конц.), НNO3)
Слайд 9
Ортофосфорная кислота Н3РО4
Является трехосновной кислотой и образует три
ряда солей:
1) средние соли, или фосфаты - Са3 (РО4)3
Которые
нерастворимы в воде, кроме фосфатов щелочных металлов
2) Кислые-дигидрофосфаты- Са(Н2РО4)2
Большинство из которых хорошо растворимы в воде
Слайд 10
Ортофосфорная кислота Н3РО4
3) Кислые-гидрофосфаты- СаНРО4
Которые малорастворимы в
воде (кроме фосфатов натрия, калия и аммония), т.е. занимают
промежуточное положение между фосфатами и дигидрофосфатами по растворимости.
Вывод: с увеличением содержания атомов водорода в молекуле соли, ее растворимость повышается.
Слайд 11
Ортофосфорная кислота Н3РО4
Химические свойства
Н3РО4 проявляет все
свойства кислот
Реагирует:
1) со щелочами: NaOH, КОН
2) с основными оксидами:
Li2O, Na2O
3) c солями: К2СО3
4) с металлами не реагирует !!! ?
(см.Таблицу растворимости)
Слайд 12
Ортофосфорная кислота Н3РО4
Химические свойства
Фосфаты всех металлов
(КромеЩМе) нерастворимы, поэтому на поверхности этих металлов образуется нерастворимая
пленка, препятствующая их дальнейшему растворению в кислоте.
ЩМе при растворении в кислоте, начинают взаимодействовать с водой.
Слайд 13
Ортофосфорная кислота Н3РО4
Химические свойства
Некоторые реакции с металлами
протекают в очень разбавленных растворах:
2 Н3РО4 (разб) + 3
Мg = Мg3(РО4 )2↓ + 3Н2↑
Слайд 14
Качественная реакция
на фосфат-ион РО43-
РО43-
+ 3 Ag+ = Ag3РО4 ↓ (желтый фосфат серебра)
Полученный
осадок растворяется в сильных кислотах.
По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr
AgCl – белого цвета
Слайд 15
Задание
Напишите уравнение диссоциации солей
Фосфата натрия
Гидрофосфата натрия
Дигидрофосфата натрия
Обратите
внимание: средние соли диссоциируют в 1 ступень (сильные электролиты),
у кислых солей – несколько ступеней диссоциации.
Слайд 16
Диссоциация солей фосфора
Вывод: Каждая последующая ступень диссоциации протекает
в меньшей степени, чем предыдущая.
Слайд 17
Тест
1.Тип кристаллической решетки у белого фосфора….
а) молекулярный
б) атомный в) ионный
а) молекулярный Р4
2. У фосфора….. аллотропных
модификаций
а) две б) три в) четыре г) пять
в) четыре – белый, черный, красный, фиолетовый
3. В атоме фосфора неспаренных электронов -…
а) три б) четыре в) пять
а) три
4. В реакции…. Фосфор проявляет восстановительные свойства
а)4Р+5О2=2Р2О5 б)2Р+3Mg=Mg3P2 в)2Р+3Н2=2РН3
а)4Р+5О2=2Р2О5