формул составьте генетический ряд.(вопросы…)
Ca(OH)2, CI2, HCI, Ca, P, CaCO3,
NaOH, CaO, CO2Решим…
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть







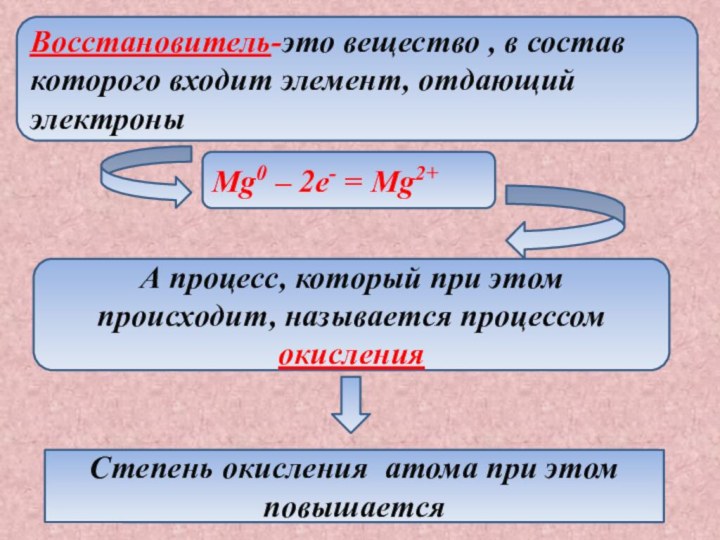







Степень окисления атома при этом повышается
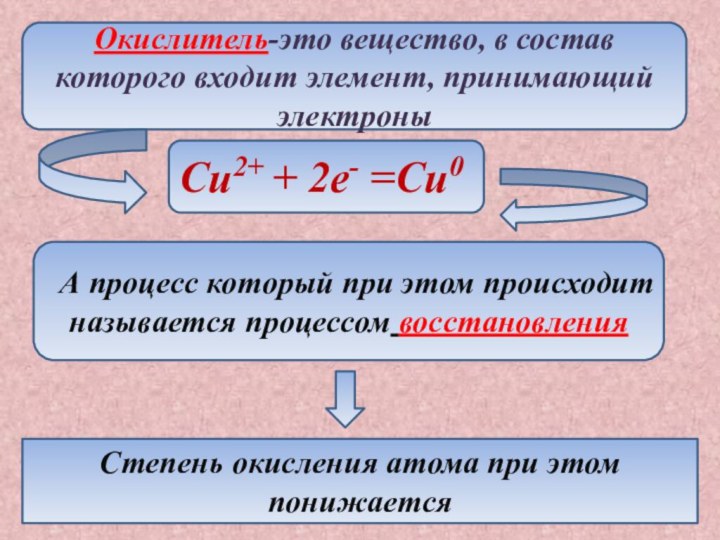
Степень окисления атома при этом понижается
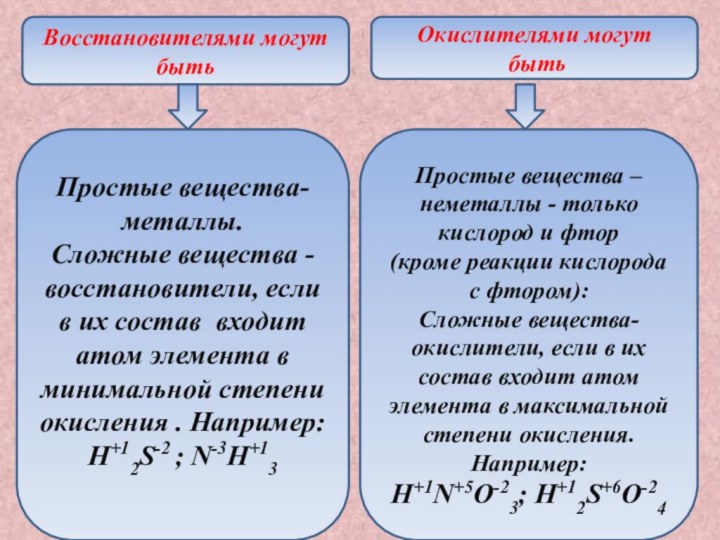
Простые вещества –неметаллы - только кислород и фтор
(кроме реакции кислорода с фтором):
Сложные вещества-окислители, если в их состав входит атом элемента в максимальной степени окисления. Например:
H+1N+5O-23; H+12S+6O-24
Далее
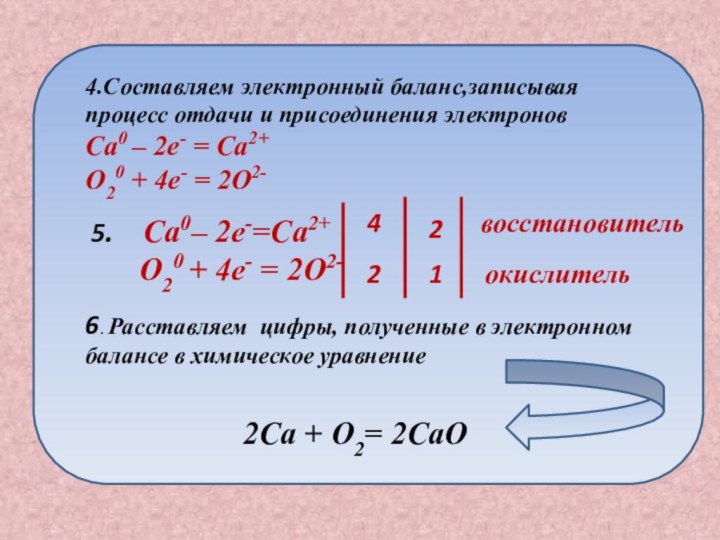
2Ca + O2= 2CaO
4.Составляем электронный баланс,записывая
процесс отдачи и присоединения электронов
Ca0 – 2e- = Ca2+
O20 + 4e- = 2O2-