- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Аллотропия (11 класс)
Содержание
- 2. Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот,
- 3. Проблема Почему существуют вещества, образованные одним химическим элементом, имеющие сильно отличающиеся физические, а иногда и химические свойства?
- 4. Гипотеза Свойства веществ определяются не только их составом, но и строением
- 5. Цели урока: повторить понятие аллотропии изучить
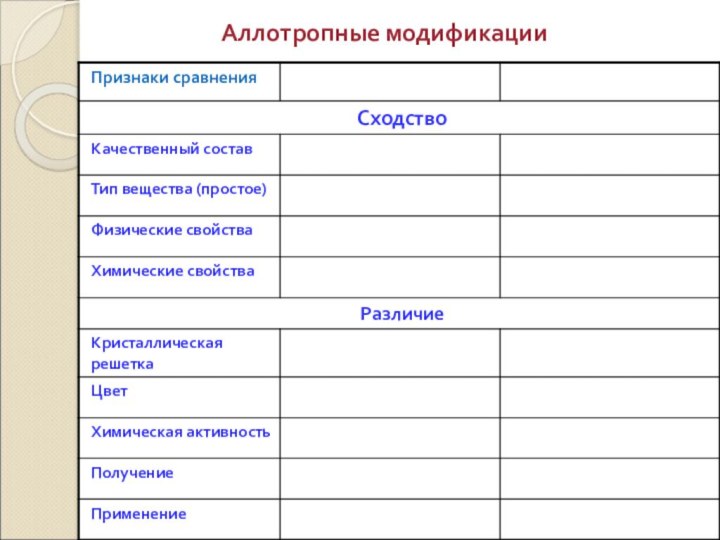
- 6. Аллотропные модификации
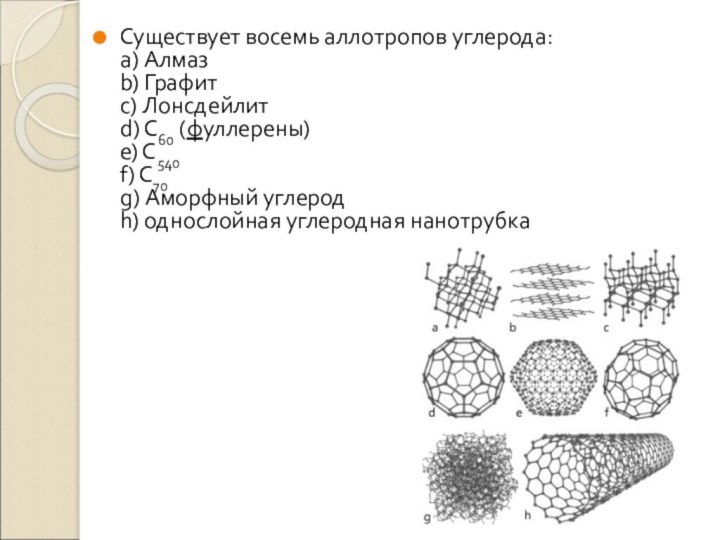
- 7. Существует восемь аллотропов углерода: a) Алмаз b)
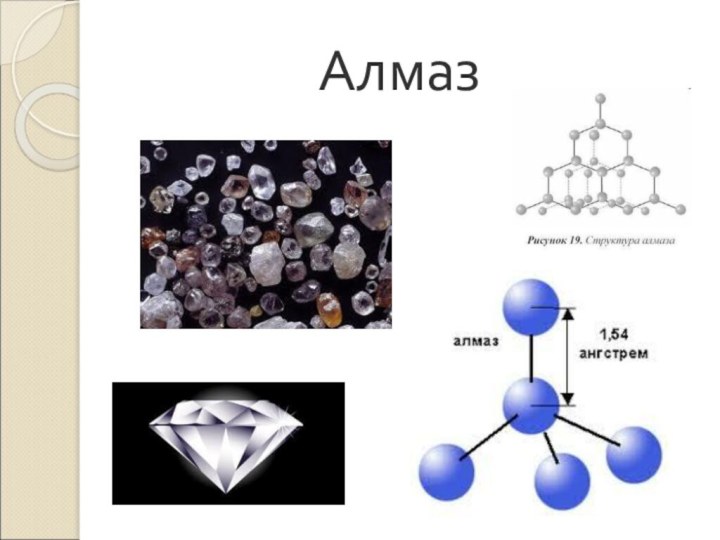
- 8. Алмаз
- 9. Алмаз- (др.-греч. ἀδάμας — «несокрушимый») – прозрачное, вещество.
- 10. Графит
- 11. Графит (от др.-греч. γράφω —
- 12. Фуллерены
- 13. Фуллерены – вещества, с четным числом атомов
- 14. Графен
- 15. Графе́н (англ. graphene) — двумерная аллотропная модификация углерода, образованная
- 16. Сера Встречается в виде нескольких модификаций.
- 17. При нагревании серы до t кипения и быстром охлаждении превращается в серу пластическую.S(ромбическая)S(пластическая)
- 18. Получение пластической серы
- 19. Фосфор Фосфор - название «фосфор» происходит от греческих
- 20.
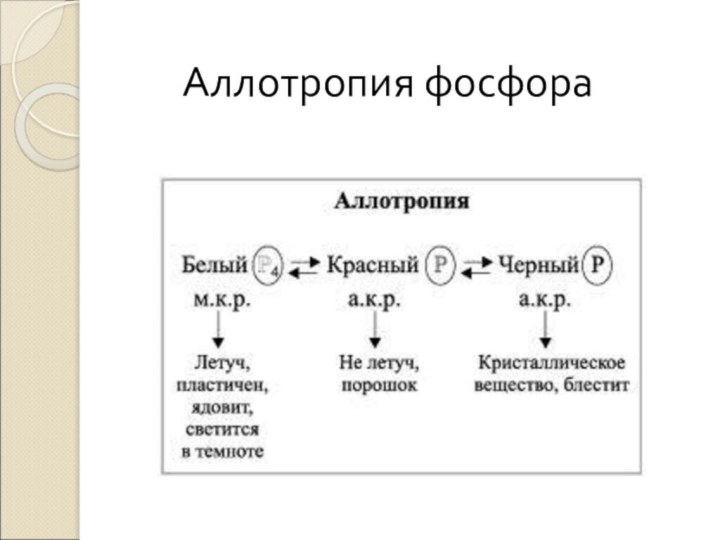
- 21. Аллотропия фосфора
- 22. Взаимопревращение фосфора можно отразить следующей схемой:P(белый)P(красный)
- 23. Кислород Кислород образует две модификации – кислород О2
- 25. Превращение кислорода в озон происходит при грозах,
- 27. Биологические свойства озона Высокая окисляющая способность озона
- 28. Получение озона в лаборатории
- 29. ОловоОбразует две модификации:белое олово и серое олово Взаимопревращение аллотропных модификаций олова: Sn(белое)Sn(серое)
- 30. Интересные факты«Оловянная чума» — одна из причин гибели
- 31. Заключение Мы доказали гипотезу о том, что различные
- 32. Выводы:Аллотропия может быть результатом образования молекул с
- 33. Взаимопревращения различных аллотропных модификаций одного химического элемента
- 34. Скачать презентацию
- 35. Похожие презентации
Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропных модификаций






















Слайд 3
Проблема
Почему существуют вещества, образованные одним химическим элементом, имеющие
сильно отличающиеся физические, а иногда и химические свойства?
Слайд 5
Цели урока:
повторить понятие аллотропии
изучить процессы взаимопревращения
различных аллотропных модификаций одного химического элемента
сравнить аллотропные модификации
одного и того же элемента между собойСлайд 7 Существует восемь аллотропов углерода: a) Алмаз b) Графит c) Лонсдейлит d) C60
(фуллерены)
e) C540
f) C70
g) Аморфный углерод
h) однослойная углеродная нанотрубка
Слайд 9 Алмаз- (др.-греч. ἀδάμας — «несокрушимый») – прозрачное, вещество. Кристаллическая
решетка объемная тетраэдрическая.
Цвет желтоватый, белый, серый, зеленоватый, реже голубой
и черный. Температура плавления выше 3500 0 С. Самое твердое вещество. Хрупок. Химически стоек. При 18000 С превращается в графитС(алмаз) <=>С(графит).
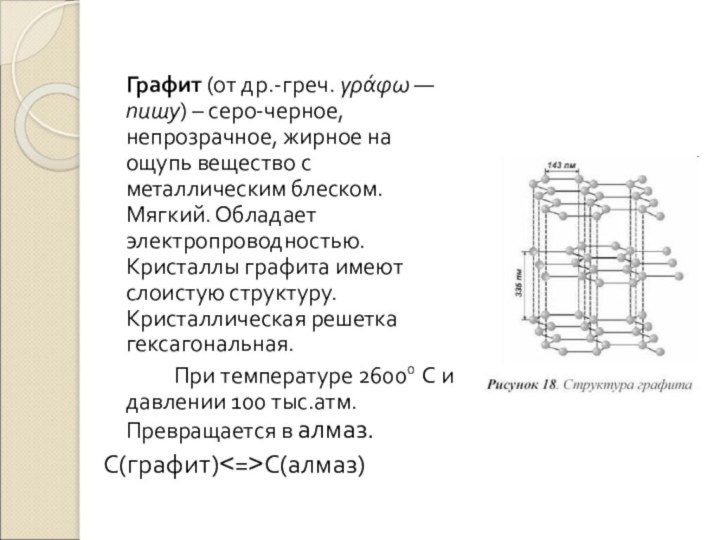
Слайд 11 Графит (от др.-греч. γράφω — пишу) –
серо-черное, непрозрачное, жирное на ощупь вещество с металлическим блеском.
Мягкий. Обладает электропроводностью. Кристаллы графита имеют слоистую структуру. Кристаллическая решетка гексагональная.При температуре 26000 С и давлении 100 тыс.атм. Превращается в алмаз.
С(графит)<=>С(алмаз)
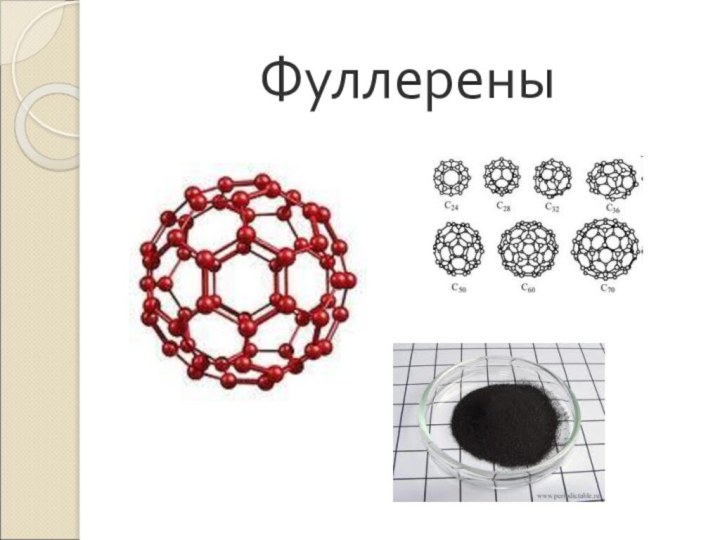
Слайд 13 Фуллерены – вещества, с четным числом атомов углерода
в молекуле:
С 60, С 70, С 72, С
74…Фуллерены образуются при
пропускании гелия через электрическую дугу между графитовыми электродами.
Слайд 15
Графе́н (англ. graphene) — двумерная аллотропная модификация углерода, образованная слоем
атомов углерода толщиной в один атом, соединенных посредством sp²
связей в гексагональную двумерную кристаллическую решётку.Его можно представить как одну плоскость графита, отделённую от объёмного кристалла.
По оценкам, графен обладает большой механической жёсткостью и хорошей теплопроводностью
Слайд 16
Сера
Встречается в виде нескольких модификаций.
Наиболее
устойчивы ромбическая – лимонно-желтая (t пл.=1130 С) и моноклинная
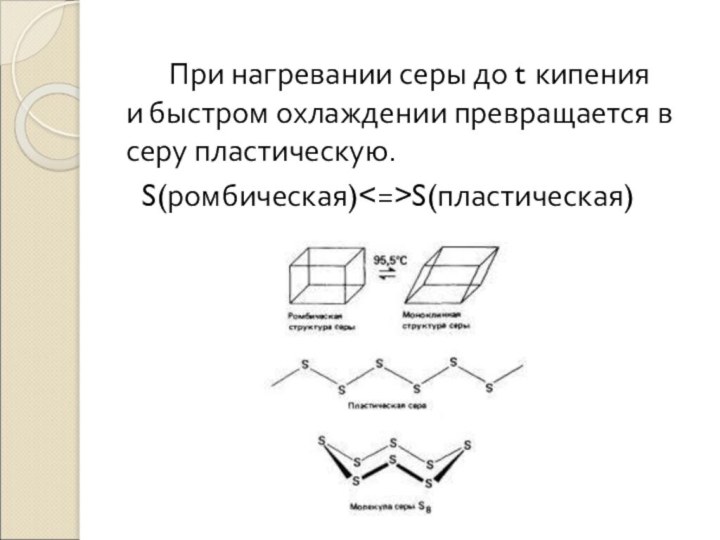
– медово-желтая (t пл.=1190 С)Слайд 17 При нагревании серы до t кипения и быстром
охлаждении превращается в серу пластическую.
S(ромбическая)S(пластическая)
Слайд 19
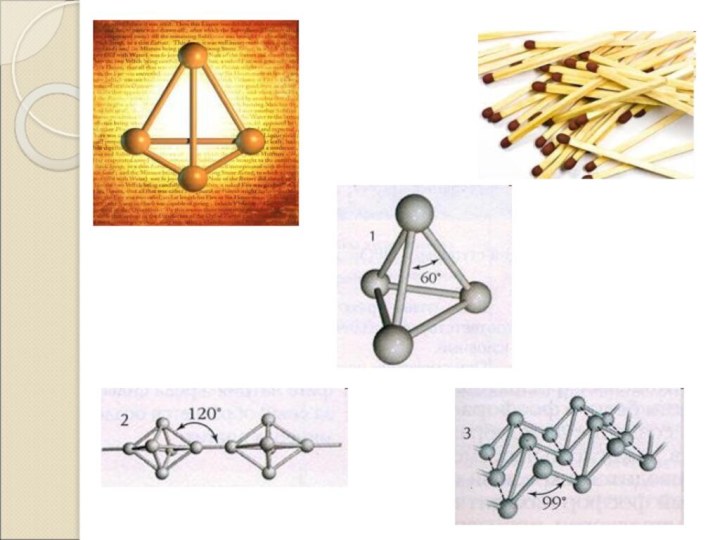
Фосфор
Фосфор - название «фосфор» происходит от греческих слов
«φῶς» — свет и «φέρω» — несу
Белый – кристаллическое вещество,
решетка молекулярная. t пл.=440 С. Чрезвычайно ядовит. Реакционноспособен.Красный – аморфный порошок, кристаллическая решетка атомная, t пл. =5900 С. Не ядовит. Менее реакционноспособен.
Слайд 23
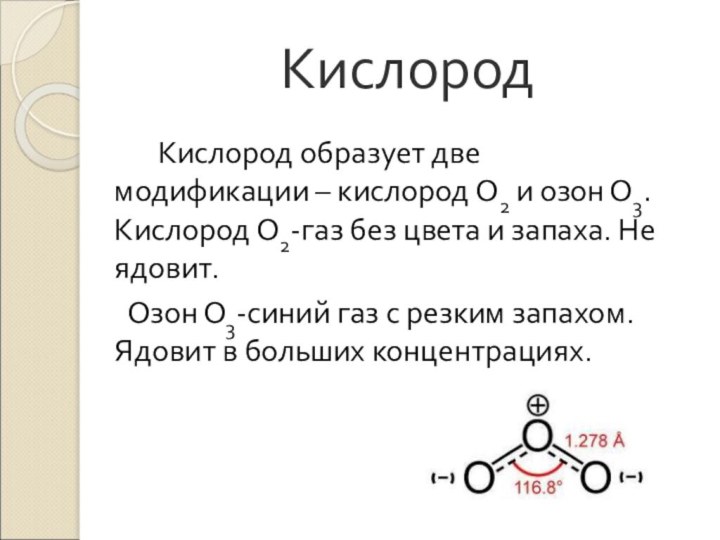
Кислород
Кислород образует две модификации – кислород О2 и
озон О3. Кислород О2-газ без цвета и запаха. Не
ядовит.Озон О3-синий газ с резким запахом. Ядовит в больших концентрациях.
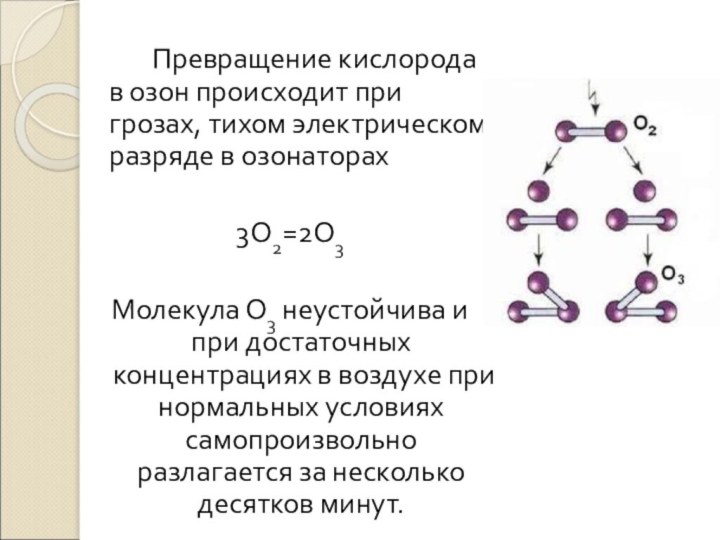
Слайд 25 Превращение кислорода в озон происходит при грозах, тихом
электрическом разряде в озонаторах
3О2=2О3
Молекула О3 неустойчива и при достаточных
концентрациях в воздухе при нормальных условиях самопроизвольно разлагается за несколько десятков минут.
Слайд 27
Биологические свойства озона
Высокая окисляющая способность озона и
образование во многих реакциях с его участием свободных радикалов
кислорода определяют его высокую токсичностьВоздействие озона на организм может приводить к преждевременной смерти.
Наиболее опасное воздействие:
на органы дыхания прямым раздражением и повреждением тканей
на холестерин в крови человека с образованием нерастворимых форм, приводящим к атеросклерозу
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ.
Слайд 29
Олово
Образует две модификации:
белое олово и серое олово
Взаимопревращение аллотропных
модификаций олова:
Sn(белое)Sn(серое)
Слайд 30
Интересные факты
«Оловянная чума» — одна из причин гибели экспедиции
Роберта Скотта к Южному полюсу в 1912 г. Она осталась
без горючего из-за того, что оно просочилось через запаянные оловом баки, поражённые «оловянной чумой», названной так в 1911 г. Г. Коэном.Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 г. — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок.
«Оловянная чума» погубила многие ценнейшие коллекции оловянных солдатиков. Например, в запасниках петербургского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.





























