- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Хром и его соединения
Содержание
- 2. Общая характеристикаЭлементы Cr, Mo (молибден) и W
- 3. Являются d-элементами. В своих соединения проявляют степени
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА-это серебристо-белые Ме, очень твердые, имеют высокие температуры плавления.
- 5. ХРОММОЛИБДЕНВОЛЬФРАМ
- 6. ХРОМРаспространенный элемент. 0,035% в литосфере. В свободном
- 7. ПОЛУЧЕНИЕ1.Металлический хром получают восстановлением оксида хрома (III)
- 8. 3.Восстановление хромита коксом получают сплав феррохром:FeO*Cr2O3 + 4C = Fe + 2Cr + 4CO (t)
- 9. ХИМИЧЕСКИЕ СВОЙСТВА ХРОМАХром при обычных условиях неактивный
- 10. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ 1.С водородом не
- 11. 4.C серой при длительном нагревание до 1000
- 12. ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ 1.При очень высокой
- 13. C конц. Серной, азотной кислотами и “царской
- 14. ПРИМЕНЕНИЕ ХРОМАВ металлургии для получения специальных сортов
- 15. Оксид и гидроксид хрома (II)Типичные основные свойства.
- 16. ОКСИД ХРОМА (III)-тугоплавкий порошок зеленого цвета , не растворяется в воде.
- 17. ПОЛУЧЕНИЕ1.(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
- 18. ХИМИЧЕСКИЕ СВОЙСТВААмфотерный. Благодаря очень прочной кристаллической решетки
- 19. ГИДРОКСИД ХРОМА (III)Типичный амфотерный гидроксид.ДЛЯ ХРОМА III
- 20. CВОЙСТВА СОЕДИНЕНИЕ Cr +6СrO3 – темно-красное кристаллическое, гигроскопическое, термически неустойчивое вещество.
- 21. При растворение оксида хрома (VI) в воде
- 22. Хромовая и дихромовая кислоты существуют только в
- 24. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЫЕ СВОЙСТВА СОЕД. ХРОМАCr +2 является сильным
- 25. Сr +6 сильный окислитель до Cr +3.
- 26. РАБОТА В КЛАССЕ
- 27. СОСТАВИТЬ ОВРА) Cr2O3 + K2CO3 +O2 =
- 28. Скачать презентацию
- 29. Похожие презентации
Общая характеристикаЭлементы Cr, Mo (молибден) и W (вольфрам) составляют побочную подгруппу шестой группы. Элемент №106 сиборгий Sg – радиоактивный элемент, искусственно полученный в 1974 г. в лаборатории г.Дубна Россия)



























Слайд 2
Общая характеристика
Элементы Cr, Mo (молибден) и W (вольфрам)
составляют побочную подгруппу шестой группы.
– радиоактивный элемент, искусственно полученный в 1974 г. в лаборатории г.Дубна Россия)Слайд 3 Являются d-элементами. В своих соединения проявляют степени окисления
от +2 до +6. Сверху вниз в подгруппе устойчивость
соединений с более высокими степенями окисления металлов увеличивается.
Слайд 4
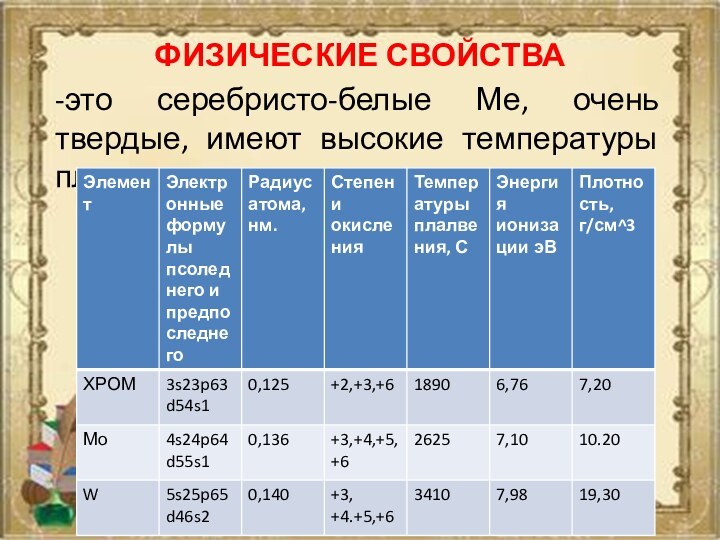
ФИЗИЧЕСКИЕ СВОЙСТВА
-это серебристо-белые Ме, очень твердые, имеют высокие
температуры плавления.
Слайд 6
ХРОМ
Распространенный элемент. 0,035% в литосфере. В свободном виде
не встречается, только в виде соединений.
Образует более 40
минералов. Самые известные:
Fe*Cr2O3 – хромистый железняк (хромит)
PbCrO4 - крокоит
Слайд 7
ПОЛУЧЕНИЕ
1.Металлический хром получают восстановлением оксида хрома (III) алюминием
при нагревание (АЛЮМИНОТЕРМИЯ) или кремнием до Si02:
Cr2O3 + 2Al
= 2Cr + Al2O3 (t)2.Электролизом водных растворов солей (см. Тему электролиз)
Слайд 8
3.Восстановление хромита коксом получают сплав феррохром:
FeO*Cr2O3 + 4C
= Fe + 2Cr + 4CO (t)
Слайд 9
ХИМИЧЕСКИЕ СВОЙСТВА ХРОМА
Хром при обычных условиях неактивный металл.
Это объясняется тем, что его поверхность покрыта оксидной пленкой
(Cr2O3), как у алюминия. При нагревание оксидная пленка хрома разрушается, и хром реагирует с простыми и сложными веществами.
Слайд 10
ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
1.С водородом не реагирует
2.Сгорание
в кислороде
4Cr + 3O2 = 2Cr2O3 (t)
3. С
галогенами при t2Cr + 3Cl2 = 2CrCl3
Слайд 11 4.C серой при длительном нагревание до 1000 градусов
цельсия:
2Сr + 3S = Cr2S3
Так же реагирует с азотом,
фосфором, углеродом, кремнием при высокой температуре.
Слайд 12
ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ
1.При очень высокой температуре
в виде порошка реагирует с водой:
2Сr + 3H2O =
Cr2O3 + 3H2 (t) 2.Реагирует с разб. Серной и соляной кислотами:
Cr + H2SO4 = Cr(+2)SO4 + H2
Cr + 2HCl = CrCl2 + H2
В воздушной среде Cr+3
Слайд 13 C конц. Серной, азотной кислотами и “царской водкой”
(смесь конц. Растворов HCl и HNO3 в соотношение 3:1)
хром при низкой температуре не реагирует , потому что эти кислоты пассивируют хром.С щелочами не реагирует (не смотря на то, что Cr(+3) амфотерный).
Слайд 14
ПРИМЕНЕНИЕ ХРОМА
В металлургии для получения специальных сортов стали,
которые имеют большую устойчивость к коррозии и обладают высокой
твердостью.Хромом покрывают другие Ме с целью предохранения их от коррозия.
Слайд 17
ПОЛУЧЕНИЕ
1.(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O (t)
2.В
промышленности получают восстановлением дихромата калия коксом или серой:
2K2Cr2O7 +3C
= 2Cr2O3 + 2K2CO3 + CO2 (t)K2Cr2O7 + S = Cr2O3 + K2SO4 (t)
Слайд 18
ХИМИЧЕСКИЕ СВОЙСТВА
Амфотерный. Благодаря очень прочной кристаллической решетки реакционноспособным
становится в жесткий условиях. (длительное нагревание при температуре около
1600 градусов цельсия).
Слайд 19
ГИДРОКСИД ХРОМА (III)
Типичный амфотерный гидроксид.
ДЛЯ ХРОМА III ИЗВЕСТНЫ
СОЛИ
– ХРОМИТЫ.
Cr2O3 +Na2CO3 = 2NaCrO2 + CO2 (t)
Слайд 20
CВОЙСТВА СОЕДИНЕНИЕ Cr +6
СrO3 – темно-красное кристаллическое, гигроскопическое,
термически неустойчивое вещество.
Слайд 21 При растворение оксида хрома (VI) в воде образуются
хромовые кислоты:
СrO3 +H2O(изб.)= H2CrO4 хромовая кислота
2CrO3 + H2O (нед.)
= H2Cr2O7 дихромовая кислота Является кислотным оксидом.
Слайд 22 Хромовая и дихромовая кислоты существуют только в водных
растворах, но образуют устойчивые соли, соответственно хроматы и дихроматы.
Хроматы и их растворы имеют желтую окраску, а дихроматы – оранжевую.CrO4 (2-) и Cr2O7 (2-) легко переходят друг в друга при изменение среды растворов.
В кислой среде хроматы превращаются в дихроматы, желтая окраска переходит в оранжевую.
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
В щелочной среде дихроматы превращаются в хроматы (оранжевая окраса изменяется на жёлтую) K2Cr2O7+2KOH = 2K2CrO4 + H2O
Слайд 24
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЫЕ СВОЙСТВА СОЕД. ХРОМА
Cr +2 является сильным восстановителем
и легко окисляется до Cr +3.
4Cr(OH)2 + O2 +
2H2O = 4Cr(OH)34CrCl2 + 4HCl + O2 = 4CrCl3 + 2H2O
Слайд 25 Сr +6 сильный окислитель до Cr +3. Дихромат
калия в кислой среде:
K2Cr2O7 + 3H2S + 4H2SO4
= 3S + Cr2(SO4)3 + K2SO4 + 7H2OРаствор дихромата калия в конц. Серной кислоте (“хромовую смесь”) применяют как окислитель для очистки стеклянной химической посуды.
Слайд 27
СОСТАВИТЬ ОВР
А) Cr2O3 + K2CO3 +O2 = K2CrO4
+ CO2
Б) K2Cr2O7 + HCl = Cl2 + KCl
+ CrCl3 + H2OВ) K2Cr2O7 + Na2SO3 + H2SO4 = K2SO4 + Cr2(SO4)3 + Na2SO4 + H2O