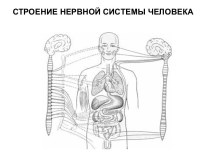
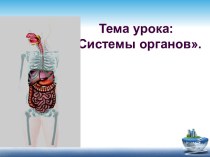
фракции или индивидуальные белки.
Электрофорез белков применяют как для анализа
компонентов смеси белков, так и для получения гомогенного белка.
Проблема: электрофоретическая подвижность зависит от заряда белка и его молекулярной массы (пространственной конфигурации)
Наиболее распространенным вариантом электрофоретического анализа белков, является электрофорез белков в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE, 1970 году Лэммли (U. K. Laemmli)).
1. белки после обработки SDS находятся в полностью денатурированном состоянии;
2. количество молекул SDS, связанных с полипептидом, пропорционально его длине, и, следовательно, молекулярной массе;
3. собственный заряд полипептида несущественен в сравнении с зарядом связанного с ним SDS.
4. Полипептиды имеют одинаковый удельный заряд и разделяются обратно пропорционально логарифму их молекулярной массы.
SDS
Для визуализации результатов электрофореза чаще всего используют окрашивание гелей красителем Кумасси (Coomassie blue) или серебром