- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему План:
Содержание
- 2. План:БелкиСтроение белковых молекул.Физические свойства.Химические свойства.Превращения белков в организме.Функции белков в организме.
- 3. Белки – это природные высокомолекулярные соединения
- 4. Строение белковых молекул. Различают четыре уровня структурной организации
- 5. Фрагмент полипептидной цепи:Пептидная связьАминокислотный остаток – структурное
- 6. Строение молекулы белка рибонуклеазы
- 7. Вторичная структура белка (для большинства белков) –
- 8. Третичная структура белка – пространственная конфигурация
- 9. Третичная структура белковой молекулы
- 10. Четвертичная структура белка – способ совместной
- 11. Физические свойства. Свойства белков так же разнообразны,
- 12. Схема процесса денатурации
- 13. 3. Цветные (качественные) реакции на белки: а) ксантопротеиновая
- 14. в) цистеиновая реакция (на остатки аминокислот,
- 15. Белки являются основой всего живого на
- 16. 6. Сократительная Выполняет все виды движений, к
- 17. ФИЗИЧЕСКИЕ СВОЙСТВА: Животные жиры – это твёрдые
- 18. Предельные кислоты:1)C15H31COOH пальмитиновая к-та2) C3H7COOH масляная к-та3)
- 20. Скачать презентацию
- 21. Похожие презентации



















Слайд 2
План:
Белки
Строение белковых молекул.
Физические свойства.
Химические свойства.
Превращения белков в организме.
Функции
белков в организме.
Слайд 3 Белки – это природные высокомолекулярные соединения (биополимеры),
структурную основу которых составляют полипептидные цепи, построенные из остатков
α-аминокислот.Протеины
(простые белки)
Макромолекулы состоят только из остатков
α-аминокислот.
Протеиды
(сложные белки)
Макромолекулы содержат
кроме остатков
α-аминокислот другие группы атомов (остатки полисахаридов,
о-фосфорной кислоты, катионы металлов и т. д. ).
Белки
Все белки являются полипептидами, но не всякий полипептид является белком. Каждый белок имеет свое специфическое (индивидуальное и постоянное) строение.
Слайд 4
Строение белковых молекул.
Различают четыре уровня структурной организации белковых
молекул.
Первичная структура белка – это число и последовательность аминокислотных
остатков в полипептидной цепи. (Полипептидную теорию строения белков предложил немецкий химик Э. Фишер в начале XX века). В организме человека свыше 10000 различных белков, и все они построены из одних и тех же 20 α-аминокислот (формулы некоторых из них приведены в табл. 490, которые соединены между собой пептидными связями. Число остатков аминокислот в молекулах белков варьирует от 50 до 105. Потенциально возможное число белков с различной первичной структурой практичеcки не ограничено.
Слайд 5
Фрагмент полипептидной цепи:
Пептидная связь
Аминокислотный остаток – структурное звено
полипептида
R1 , R2 , R3 , R4 – радикалы
α-аминокислотОдин из первых белков, первичная структура которого была установлена в 1954г., - гормон инсулин (регулирует содержание сахара в крови), егомолекула состоит из двух полипептидных цепей, которые связаны друг с другом ( в одной цепи 21 аминокислотный остаток, в другой – 30), Мr (инсулина)=5700.Другой белок – фермент рибонуклеаза – состоит из 124 аминокислотных остатков и имеет Мr≈ 15000 (рис.20).Белок крови – гемоглобин имеет Мr ≈68000.Белки некоторых вирусов имеют Мr до 50 млн.Относительная молекулярная масса белков изменяется в широких пределах: от 5 тыс. до десятков миллионов.
Слайд 7 Вторичная структура белка (для большинства белков) – это
ά-спираль, которая образуется в результате скручивания полипептидной цепи за
счет водородных связей между группами: –С– и –N– (рис.21)║ │
О Н
Теоретически все –С– и –N– группы могут участвовать в образовании водородных связей. ║ │
О Н
Поэтому вторичная структура очень стабильна. В одном витке спирали обычно содержится 3,6 аминокислотного остатка. Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Существуют белки, имеющие другие типы вторичной структуры.
Слайд 8
Третичная структура белка – пространственная конфигурация спирали.
У
большинства белков полипептидные цепи свернуты особым образом в «клубок»
- компактную «глобулу». Эта структура поддерживается за счет гидрофобных взаимодействий, а также водородных, дисульфидных , ионных и других связей.В количественном отношении наиболее важны гидрофобные (от греч. «гидро» - вода, «фобос» - страх) взаимодействия. Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу.
В результате взаимодействия между различными функциональными группами полипептидной цепи образуются: дисульфидные мостики (-S-S-), в создании которых участвуют атомы серы серусодержащих аминокислот (например, цистеина); солевые мостики (NH3+COO-) – получаются при взаимодействии карбоксильных и аминогрупп О
//
(ионная связь; сложноэфирные мостики ( -О-С ) – результат взаимодействия карбоксильных и гидроксильных групп . \
Существуют белки, у которых третичная структура почти или совсем не выражена.
Слайд 10 Четвертичная структура белка – способ совместной укладки
нескольких полипептидных цепей; образующиеся структуры называются ассоциатами.
Например, гемоглобин (белок
крови) – это сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода. Из тканей гемоглобин выносит углекислый газ молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода.
Четвертичная структура белка (ассоциат, образованный четырьмя полипептидными цепями).
Слайд 11
Физические свойства.
Свойства белков так же разнообразны, как
и функции, которые они выполняют . Одни белки растворяются
в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).Химические свойства.
В радикалах аминокислотных остатков белки содержат различные функциональные группы, которые способны вступать во многие реакции. Белки вступают в реакции окисления-восстановления, этерификации, алкилирования, нитрования, могут образовывать соли как с кислотами, так и с основаниями (белки амфотерны).
1. Гидролиз белков:
Н+, t Н+, t Н+, t
Белки + Н2О Полипептиды + Н2О Олигопептиды + Н2О
Н+, t
Дипептиды + Н2О α-Аминокислоты
2. Осаждение белков:
а) обратимое (высаливание):
спирт, соли Na+, K+, NH4+ Белок с измененной
Белок в вторичной и третичной
растворе кислоты, УФ-лучи, tº, γ-лучи структурой
Слайд 13
3. Цветные (качественные) реакции на белки:
а) ксантопротеиновая реакция
(на остатки аминокислот, содержащих бензольные кольца):
Белок + HNO3(конц.) → желтое окрашивание+
HNO3(конц.)
–Н2О
Остаток фенилаланина
(желтый цвет)
б) биуретовая реакция (на пептидные связи):
Белок + CuSO4 + NaOH —→ Ярко-фиолетовое окрашивание
(насыщ.) (конц.)
Слайд 14 в) цистеиновая реакция (на остатки аминокислот, содержащих
серу):
Белок
+ NaOH + Pb(CH3COOH)2 → Черное окрашиваниеАцетат свинца (II)
Pb2+ + S2- → PbS↓
ч.ц.
Превращения белков в организме.
Белки пищи
Полипептиды
α-Аминокислоты
СО2 , NH3 , H2O
Энергия
Белки организма
Ферменты
(Желудок)
(Кишечник)
Ферменты
Слайд 15 Белки являются основой всего живого на Земле
и выполняют в организмах многообразные функции.
Функции белков в организме.
1.
Пластическая Строительный материал Например, коллаген,клетки мембранные клетки
2. Транпортная Переносят различные Например, гемоглобин
вещества (перпенос О2 и СО2)
3. Защитная Обезвреживают чужерод- Например, γ-глобулин
ные вещества сыворотки крови
4. Энергетическая Снабжают организм При расщеплении 1 г
энергией белка освобождается
17,6 кДж энергии
Каталитическая Ускоряют протекание Все ферменты по
химических реакций своей химической
организме природе являются
белками. Например,
рибонуклеаза
Слайд 16
6. Сократительная
Выполняет все виды движений, к которым
способны клетки
Например, миозин (белок мышц)
7. Регуляторная
Регулируют обменные процессы
Гормоны,
например, инсулин (обмен глюкозы)Существуют белки, выполняющие специфические функции, например, рецепторные, - обеспечивают передачу импульсов между нервными клетками и др.
Белки – необходимая составная часть пищи человека, отсутствие или недостаток их в пище может вызвать серьезные заболевания.
ПРИМЕНЕНИЕ В МЕДИЦИНЕ
ЖИРЫ. МЫЛА. ПОНЯТИЕ О СМС.
ЖИРЫ.
Жиры – это сложные эфиры, образованные высшими карбоновыми кислотами и трёхатомным спиртом глицерином. Общее название таких соединений – ТРИГЛИЦЕРИДЫ.
Слайд 17
ФИЗИЧЕСКИЕ СВОЙСТВА:
Животные жиры – это твёрдые вещества.
Растительные
жиры – жидкие вещества (называются по другому маслами).
Все жиры
легче воды, в воде не растворимы, но растворимы в бензине, дихлорэтане, эфире, сероуглероде, тетрахлориде. Жиры хорошо впитываются бумагой и кожей.СХЕМА ОБРАЗОВАНИЯ ЖИРОВ:
O O
CH2 – OH HO – C – R1 CH2 – O – C – R1
| | O t, K | O
CH – OH + HO – C – R2 CH – O – C – R2 + 3H2O
| | O | O
CH2 – OH HO – C – R3 CH2 – O – C – R3
глицерин кислоты жир
R1, R2, R3 – углеводородные радикалы. Они могут быть одинаковыми и разными.
В состав жиров чаще всего входят остатки следующих карбоновых кислот:
Слайд 18
Предельные кислоты:
1)C15H31COOH пальмитиновая
к-та
2) C3H7COOH масляная к-та
3) C17H35COOH
стеариновая к-та
Непредельные кислоты:
1) C17H33COOH олеиновая к-та
2) C17H31COOH линолевая
к-та 3) C17H29COOH линоленовая к-та
Жиры, образованные предельными кислотами – это твёрдые жиры. Жиры образованные главным образом непредельными кислотами – жидкие жиры.
O
CH2 – OH C17H35COOH CH2 – O – C – C17H35
| t, K | O
CH – OH + C17H35COOH CH – O – C – C17H35 + 3H2O
| | O
CH2 – OH C17H35COOH CH2 – O – C – C17H35
Глицерин стеариновая к-та стеариновый триглицерид
Гидрогенизация – это реакция, с помощью которой жидкие жиры превращаются в твёрдые.
Слайд 19
O
OCH2 – O – C – C17H33 CH2 – O – C – C17H35
| O t, K | O
CH – O – C – C17H33 + 3H2 CH – O – C – C17H35
| O | O
CH2 – O – C – C17H33 CH2 – O – C – C17H35
триолеат глицерина стеариновый триглицерид
(жидкий жир) (твёрдый жир)
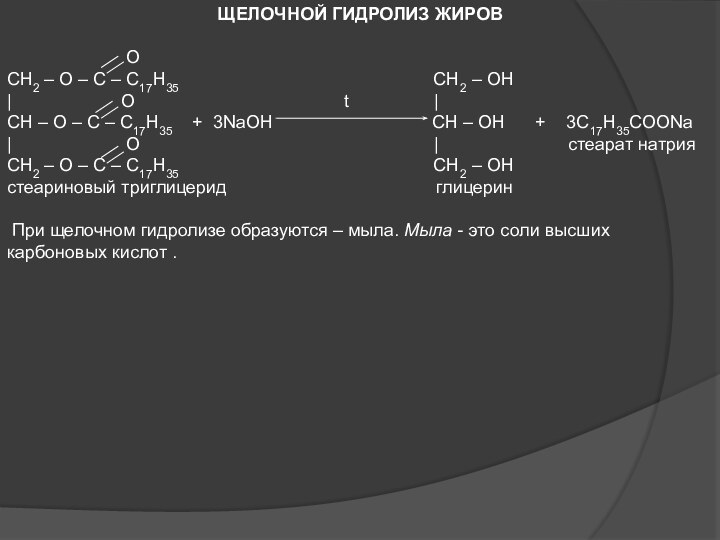
КИСЛОТНЫЙ ГИДРОЛИЗ ЖИРОВ
O
CH2 – O – C – C17H35 CH2 – OH
| O t |
CH – O – C – C17H35 + 3HOH CH – OH + 3C17H35COOH
| O | стеариновая
CH2 – O – C – C17H35 CH2 – OH кислота
стеариновый триглицерид глицерин





























