- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему α-Аминокислоты. Пептиды. Белки.
Содержание
- 2. Аминокислоты — гетерофункциональные соединения, содержащие NH2 и
- 4. Аминокислоты представляют собой твердые кристаллические тугоплавкие вещества,
- 5. Классификация биогенных аминокислот: По химической природе
- 6. По химической природе радикалаАлифатическиеАроматические
- 7. По полярности бокового радикалаС неполярными (гидрофобными) радикалами
- 8. С полярными (гидрофильными) радикалами
- 9. По количеству кислотно-основных группНейтральные
- 10. Химические свойства аминокислот кислотно-основные свойства; реакции по
- 11. Кислотно-основные свойстваАминокислоты являются амфотерными соединениями, так как
- 12. Амфотерные свойства аминокислот проявляются и в их
- 13. Реакции по NH2-группе Реакция с формальдегидом. Лежит
- 14. Реакция с азотистой кислотой. Используется для объемного
- 15. Образование N-ацильных производных. Используется для «защиты» аминогрупп при пептидном синтезе.
- 16. Реакции по COOH-группе Реакция этерификации. Используется для «защиты» карбоксильной группы при пептидном синтезе.
- 17. Реакция образования галогенангидридов. Используется для активации карбоксильной группы при пептидном синтезе.
- 18. Специфические реакцииДекарбоксилированиеin vitroin vivo
- 19. Трансаминирование
- 20. ДезаминированиеОкислительное дезаминирование
- 21. Неокислительное дезаминирование. Приводит к образованию α,β-ненасыщенных кислот.
- 22. Образование пептидов и белковПептиды и белки —
- 24. Свойства пептидной связи4 Атома связи (C, N,
- 25. Основные функции пептидоврегуляторная (энкефалины, эндорфины);гормональная (окситоцин, вазопрессин,
- 26. Структурная организация белковых молекулДля белковых молекул известна первичная, вторичная, третичная и четвертичная структуры.
- 27. Первичная структура белка – это аминокислотная последовательность, т.е. порядок чередования аминокислотных остатков.
- 28. Вторичная структура белка образуется за счет водородных
- 29. Второй тип – β-структура (структура складчатого листа).
- 30. Третичная структура белка – это компактная упаковка
- 31. ИонноевзаимодействиеВодородные связиГидрофобныевзаимодействияДисульфидные мостики
- 32. Четвертичная структура белка – это трехмерные ассоциаты,
- 33. Разрушение природной макроструктуры белка называется денатурацией. Первичная
- 34. Скачать презентацию
- 35. Похожие презентации
Аминокислоты — гетерофункциональные соединения, содержащие NH2 и COOH группы. ,L-аминокислоты.В природе существует около 300 аминокислот.20 из них являются структурными блоками пептидов и белков.

































Слайд 2 Аминокислоты — гетерофункциональные соединения, содержащие NH2 и COOH
группы.
являются структурными блоками пептидов и белков.Слайд 4 Аминокислоты представляют собой твердые кристаллические тугоплавкие вещества, плохо
растворимые в органических растворителях, хорошо растворимые в воде.
Их
кристаллическая решетка образована биполярными ионами, или цвиттер-ионами.
Слайд 5
Классификация биогенных аминокислот:
По химической природе радикала
R
По полярности бокового радикала
По количеству кислотно-основных групп
Слайд 10
Химические свойства аминокислот
кислотно-основные свойства;
реакции по NH2
группе;
реакции по COOH группе;
особые свойства аминокислот как
гетерофункциональных соединений.
Слайд 11
Кислотно-основные свойства
Аминокислоты являются амфотерными соединениями, так как содержат
и кислотный (COOH) и основной (NH2) центры.
Значение pH
при котором содержание диполярного иона максимально называется изоэлектрической точкой (pI).Слайд 12 Амфотерные свойства аминокислот проявляются и в их способности
образовывать соли, реагируя как с кислотами, так и с
основаниями.
Слайд 13
Реакции по NH2-группе
Реакция с формальдегидом. Лежит в
основе метода формольного титрования аминокислот щелочью по методу Серенсена.
Слайд 14 Реакция с азотистой кислотой. Используется для объемного анализа
(по количеству выделившегося азота) аминосодержащих природных соединений (метод Ван-Слэйка).
Слайд 15 Образование N-ацильных производных. Используется для «защиты» аминогрупп при
пептидном синтезе.
Слайд 16
Реакции по COOH-группе
Реакция этерификации. Используется для «защиты»
карбоксильной группы при пептидном синтезе.
Слайд 17 Реакция образования галогенангидридов. Используется для активации карбоксильной группы
при пептидном синтезе.
Слайд 22
Образование пептидов и белков
Пептиды и белки — природные
или синтетические вещества, построенные из остатков -аминокислот, соединенных амидными
(пептидными) связями. До 100 аминокислотных остатков – пептиды, > 100 – белки.
Слайд 24
Свойства пептидной связи
4 Атома связи (C, N, O
и H) и 2 α-углерода находятся в одной плоскости.
R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.H и O в пептидной связи, а также α-углероды двух аминокислот транс-ориентированы.
Вращение вокруг связи C-N затруднено, возможно вращение вокруг С-С связи.
Слайд 25
Основные функции пептидов
регуляторная (энкефалины, эндорфины);
гормональная (окситоцин, вазопрессин, брадикинин,
гастрин, инсулин);
антибиотическая (грамицидин А, В, С, S; актиномицин D);
антиоксидантная
(глутатион);функция витаминов (фолиевая кислота);
пептидные алкалоиды (эрготамин);
токсическая (фаллоидин, амантидин).
Слайд 26
Структурная организация белковых молекул
Для белковых молекул известна первичная,
вторичная, третичная и четвертичная структуры.
Слайд 27 Первичная структура белка – это аминокислотная последовательность, т.е.
порядок чередования аминокислотных остатков.
Слайд 28 Вторичная структура белка образуется за счет водородных связей
между карбонильными группами и атомами водорода в группах NH.
Выделяют два типа вторичной структуры. Первый – α-спираль.Наиболее характерна правозакрученная спираль.
Слайд 30 Третичная структура белка – это компактная упаковка полипептидных
цепей в пространстве, возникающая при взаимодействии боковых радикалов остатков
аминокислот.В формировании третичной структуры участвуют ионные, водородные и ковалентные связи а также гидрофобное взаимодействие.
Слайд 32 Четвертичная структура белка – это трехмерные ассоциаты, состоящие
из нескольких полипептидных цепей несвязанных между собой ковалентными связями.
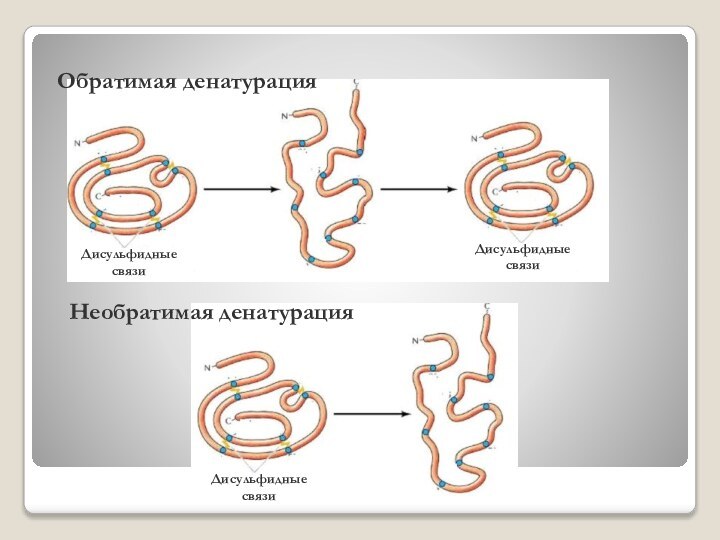
Слайд 33 Разрушение природной макроструктуры белка называется денатурацией. Первичная структура
при этом сохраняется.
Денатурация происходит при повышении температуры, изменении
pH, воздействии химических реагентов. У денатурированных белков происходит полная потеря биологической активности.





























