- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Водород
Содержание
- 2. Водород самый распространенный элемент во вселенной
- 3. История открытияВпервые этот газ в чистом виде
- 4. Другой великий химик, француз Антуан-Лоран Лавуазье, уже
- 5. Общая характеристика:Водород занимает первое место в периодической
- 7. Водород в природе:Водород широко распространен в природе
- 8. Каждую секунду Солнце излучает в космическое пространство
- 9. За время существования Солнца уже около половины
- 10. Молекула водорода Молекула водорода состоит из двух
- 11. Физические свойства.Водород — это самый легкий газ
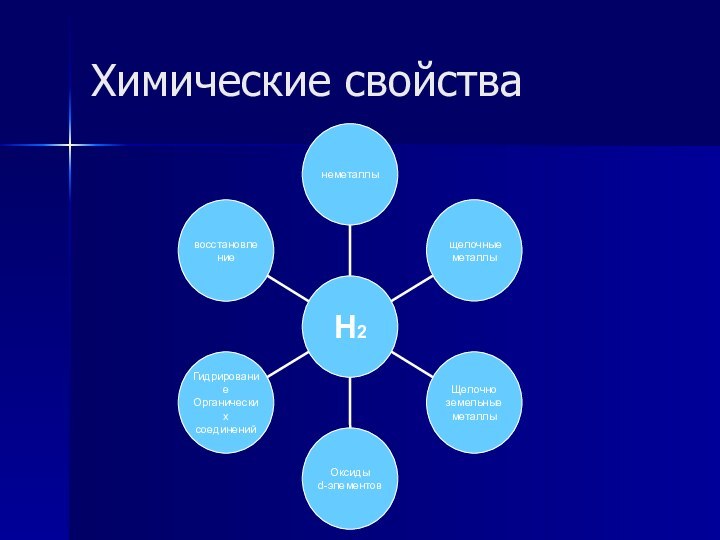
- 12. Химические свойства
- 13. Получение:Вплоть до конца XIX века получение водорода
- 14. Эксперимент по получению водорода из воды с помощью солнечной энергии
- 15. Применение:Наработав в достаточном количестве этот легкий газ,
- 16. Водородная энергетикаВ недалёком будущем основным источником получения
- 17. Водородные автомобилиВ 1979 году компания BMW выпустила
- 19. Водород и будущее Слова «дейтерий» и «тритий»
- 20. Скачать презентацию
- 21. Похожие презентации
Водород самый распространенный элемент во вселенной
















Слайд 4
Другой великий химик, француз Антуан-Лоран Лавуазье, уже в
1787 году доказал, что полученное Кавендишем вещество — вполне
обычный, хотя и очень интересный химический элемент. Свое название он получил оттого, что при горении давал не дым, сажу и копоть, а воду.
Слайд 5
Общая характеристика:
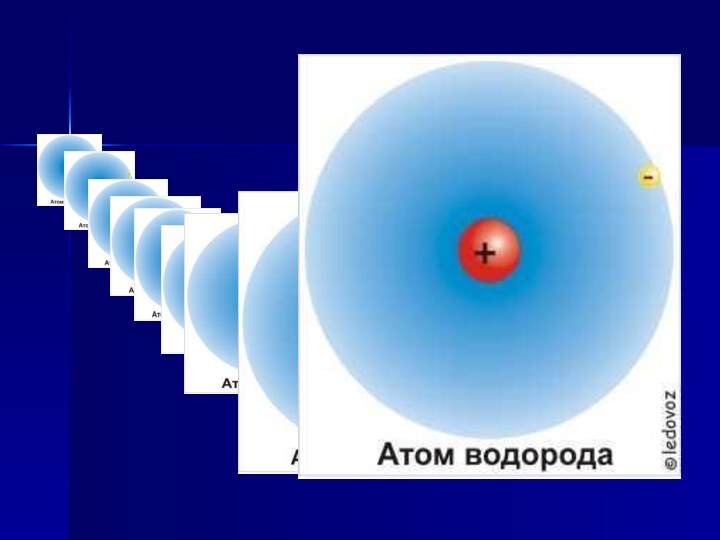
Водород занимает первое место в периодической системе
(Z = 1). Он имеет простейшее строение атома: ядро
атома окружено электронным облаком. Электронная конфигурация 1s1.В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон). Однако по свойствам он более сходен с галогенами, чем со щелочными металлами. Поэтому водород помещают в VII группу периодической системы элементов Д.И. Менделеева, а в I группе символ водорода заключают в скобки.
Слайд 7
Водород в природе:
Водород широко распространен в природе —
содержится в воде, во всех органических соединениях, в свободном
виде — в некоторых природных газах. Содержание его в земной коре достигает 0,15% ее массы (с учетом гидросферы — 1%). Водород составляет половину массы Солнца.
Слайд 8
Каждую секунду Солнце излучает в космическое пространство энергию,
эквивалентную примерно 4 млн т массы. Эта энергия рождается в ходе
слияния четырех ядер водорода, протонов, в ядро гелия;
Слайд 9
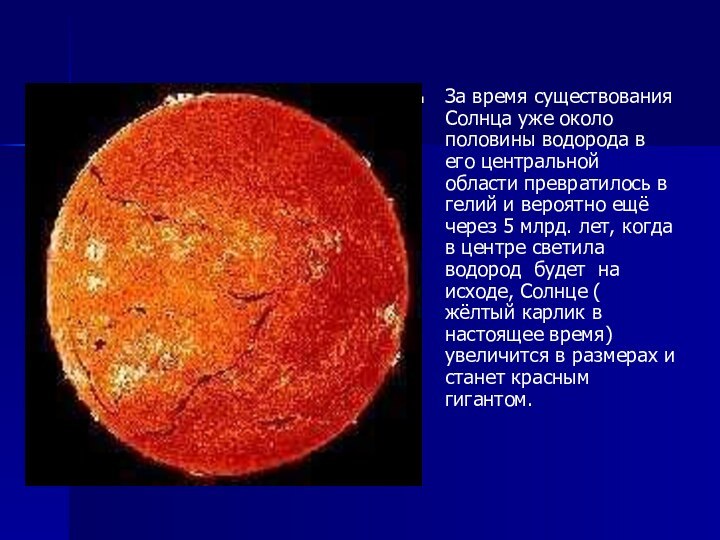
За время существования Солнца уже около половины водорода
в его центральной области превратилось в гелий и вероятно
ещё через 5 млрд. лет, когда в центре светила водород будет на исходе, Солнце ( жёлтый карлик в настоящее время) увеличится в размерах и станет красным гигантом.
Слайд 10
Молекула водорода
Молекула водорода состоит из двух атомов.
Возникновение связи между ними объясняется образованием обобщенной пары электронов
(или общего электронного облака):Н:Н или Н2
Благодаря этому обобщению электронов молекула Н2 более энергетически устойчива, чем его отдельные атомы. Чтобы разорвать в 1 моль водорода молекулы на атомы, необходимо затратить энергию 436 кДж:
Н2 = 2Н, ∆H° = 436 кДж/моль
Этим объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
Слайд 11
Физические свойства.
Водород — это самый легкий газ (он
в 14,4 раза легче воздуха), не имеет цвета, вкуса
и запаха. Мало растворим в воде (в 1 л воды при 20°С растворяется 18 мл водорода). При температуре — 252,8°С и атмосферном давлении переходит в жидкое состояние. Жидкий водород бесцветен.Кроме водорода с массовым числом 1 существуют изотопы с массовыми числами 2 и 3 — дейтерий D и тритий Т.
ГазообразныйГазообразный водород может существовать в двух формах (модификациях) — в виде ортоГазообразный водород может существовать в двух формах (модификациях) — в виде орто- и пара- водорода.
В молекуле ортоводорода (т. пл. -259,20 °С, т. кип. -252,76 °С) ядерные спины направлены одинаково (параллельны), а у параводорода (т. пл. -259,32 °С, т. кип. -252,89 °С) — противоположно друг другу (антипараллельны).
Слайд 13
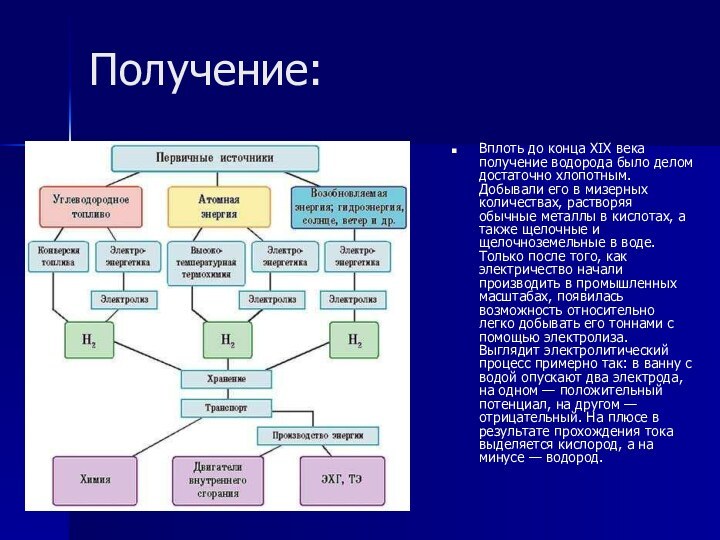
Получение:
Вплоть до конца XIX века получение водорода было
делом достаточно хлопотным. Добывали его в мизерных количествах, растворяя
обычные металлы в кислотах, а также щелочные и щелочноземельные в воде. Только после того, как электричество начали производить в промышленных масштабах, появилась возможность относительно легко добывать его тоннами с помощью электролиза. Выглядит электролитический процесс примерно так: в ванну с водой опускают два электрода, на одном — положительный потенциал, на другом — отрицательный. На плюсе в результате прохождения тока выделяется кислород, а на минусе — водород.
Слайд 15
Применение:
Наработав в достаточном количестве этот легкий газ, люди
сначала приспособили его для воздушных полетов. В этом качестве
первый элемент Таблицы Менделеева применяли вплоть до 1937 года, когда в воздухе сгорел крупнейший в мире, в два футбольных поля размером, заполненный водородом немецкий дирижабль «Гинденбург». Катастрофа унесла жизни 36 человек, и на таком использовании водорода был поставлен крест. С тех пор аэростаты заправляют исключительно гелием. Гелий — газ, увы, более плотный, но зато негорючий. .
Слайд 16
Водородная энергетика
В недалёком будущем основным источником получения энергии
станет реакция горения водорода, и водородная энергетикаВ недалёком будущем
основным источником получения энергии станет реакция горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии (угольВ недалёком будущем основным источником получения энергии станет реакция горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии (уголь, нефтьВ недалёком будущем основным источником получения энергии станет реакция горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии (уголь, нефть и др.). При этом предполагалось, что для получения водорода в больших масштабах можно будет использовать электролиз воды.
Слайд 17
Водородные автомобили
В 1979 году компания BMW выпустила первый
автомобиль, вполне успешно ездивший на водороде, при этом не
взрывавшийся и выпускавший из выхлопной трубы водяной пар. В эпоху усиливающейся борьбы с вредными выхлопами машина была воспринята как вызов консервативному автомобильному рынку. Вслед за BMW в экологическую сторону потянулись и другие производители. К концу века каждая уважающая себя автокомпания имела в запаснике хотя бы один концепт-кар, работающий на водородном топливе.
Слайд 19
Водород и будущее
Слова «дейтерий» и «тритий» напоминают нам
о том, что сегодня человек располагает мощнейшим источником энергии,
высвобождающейся при реакции:21Н + 31Н → 42Не +10n + 17,6 МэВ.
Эта реакция начинается при 10 млн градусов и протекает за ничтожные доли секунды при взрыве термоядерной бомбы, причем выделяется гигантское по масштабам Земли количество энергии.
Водородные бомбы иногда сравнивают с Солнцем. Однако мы уже видели, что на Солнце идут медленные и стабильные термоядерные процессы. Солнце дарует нам жизнь, а водородная бомба – сулит смерть...