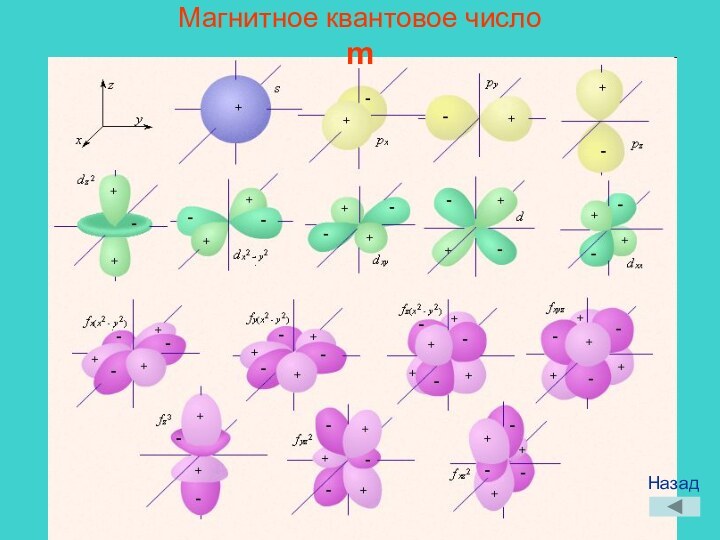
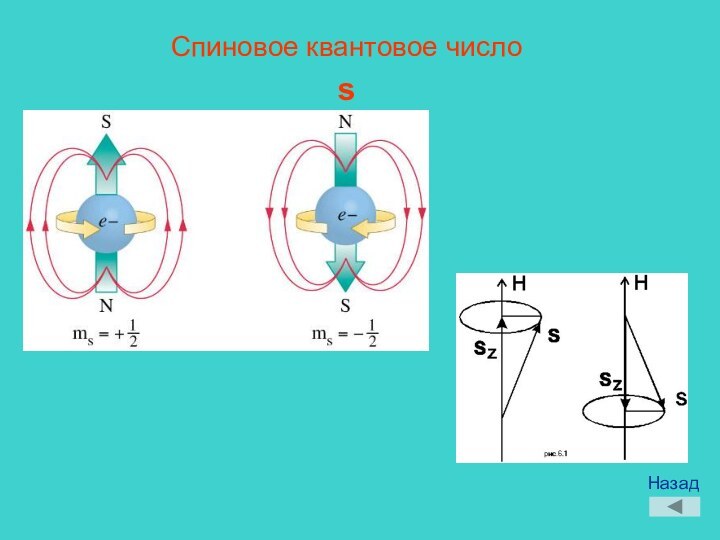
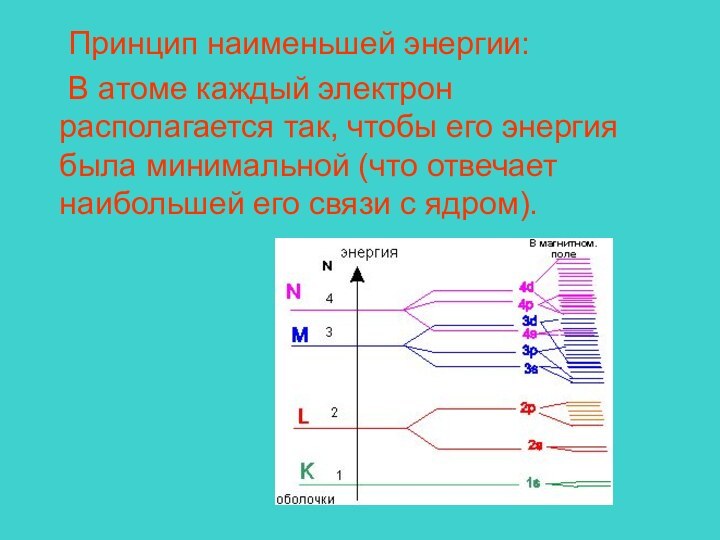
Пьер Реймон,
7-й герцог Брольи)
(1892-1987)
Лауреат нобелевской премии
(1929)Электрон обладает двойственными корпускулярно-волновыми свойствами (как свет), то есть проявляет одновременно свойства частицы и волны.