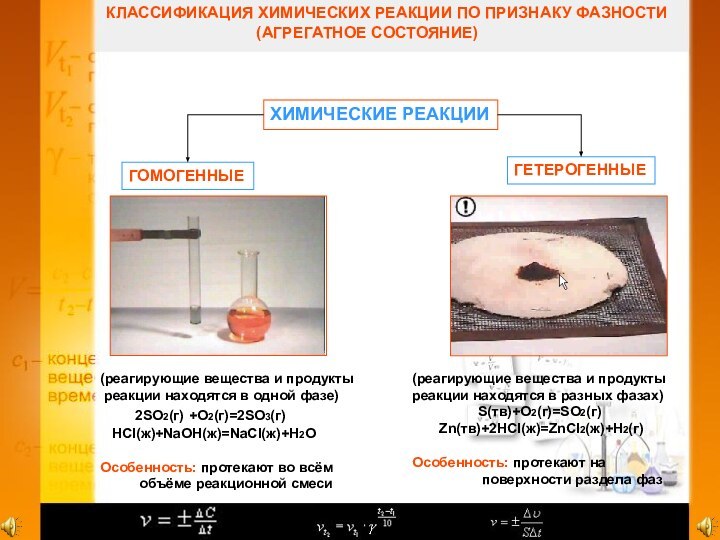
(АГРЕГАТНОЕ СОСТОЯНИЕ)
ХИМИЧЕСКИЕ РЕАКЦИИ
ГОМОГЕННЫЕ
ГЕТЕРОГЕННЫЕ
(реагирующие вещества и продукты
реакции находятся в одной фазе)
2SO2(г) +O2(г)=2SO3(г)
HCl(ж)+NaOH(ж)=NaCl(ж)+H2O
Особенность: протекают во всём
объёме реакционной смеси
(реагирующие вещества и продукты
реакции находятся в разных фазах)
S(тв)+O2(г)=SO2(г)
Zn(тв)+2HCl(ж)=ZnCl2(ж)+H2(г)
Особенность: протекают на
поверхности раздела фаз


![Скорость химической реакции. Факторы влияющие на скорость химических реакций Факторы влияющие на скорость химической реакцииКонцентрация А+B=C+D V=k[A]*[B]Природа реагирующих веществПлощадь поверхности соприкосновениятемпературакатализатор](/img/tmb/14/1364006/9779e8d21fe7d6a9e7886e0f9ee0afed-720x.jpg)