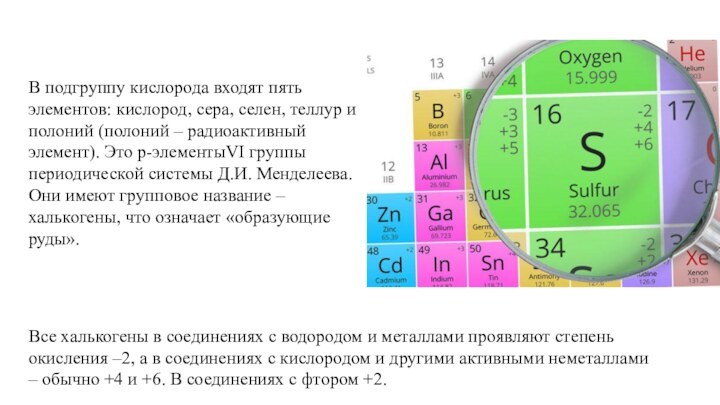
сгорании ее на воздухе или в кислороде образуется оксид
серы (IV)SO2 и частично оксид серы (VI)SO3:
S + O2 = SO2↑
2S + 3O2 = 2SO3
Сернистый газ SO2 – бесцветный газ с удушливым резким запахом. Яд!
При растворении его в воде (при 00С 1 объем воды растворяет более 70 объемов SO2) образуется сернистая кислота H2SO3, которая известна только в растворах.
Серный ангидрид SO3 при комнатной температуре представляет собой бесцветную легко летучую жидкость (tкип=44,80С,tпл=16,80С), которая со временем переходит в асбестовидную модификацию, состоящую из блестящих шелковистых кристаллов. Волокна серного ангидрида устойчивы лишь в запаянном сосуде.
Поглощая влагу воздуха, они превращаются в густую бесцветную жидкость – олеум (от лат. oleum– «масло»). С водой SO3 взаимодействует очень энергично: при этом выделяется так много теплоты, что образующиеся мельчайшие капельки серной кислоты создают туман. Работать с этим веществом нужно крайне осторожно!