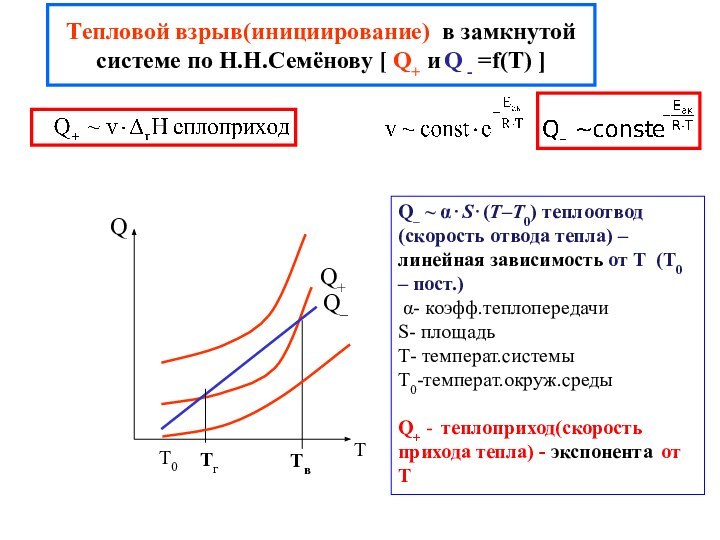
химической реакции(10-13-10-15 с)
AB + CD → AD + CB
Элементарная
(простая) химическая реакция протекает при непосредственном взаимодействии исходных частиц, идет в одну стадию ипредставляет собой совокупность элементарных химических актов
1. Встреча молекул исходных веществ и непосредств.взаимодействие: AB и CD
2. Перестройка химических связей с образованием молекул продуктов: AD и CB