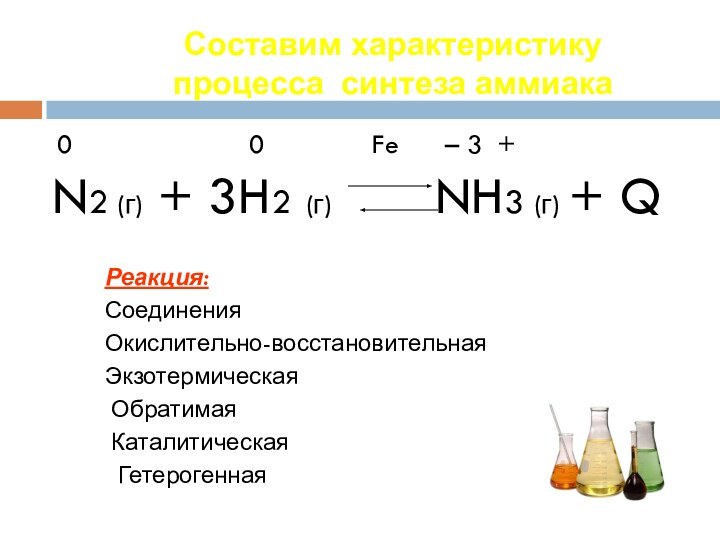
протекания, познакомиться с экзо- и эндотермическими реакциями.
Развивать умения анализировать,
выделять главное, устанавливать причинно-следственные связи, исходя из строения и свойств веществ, умение владеть химической терминологией, четко формулировать и высказывать мысли.Привить интерес к предмету. Показать важность знания химии в повседневной жизни.