- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ
Содержание
- 2. Цели:Изучить строение, свойства, получение и применение спиртов;Уметь
- 3. План:Классификация спиртов.Гомологический ряд. Номенклатура. Изомерия.Способы получения.Строение молекулы спиртов.Химические свойства спиртов.Применение спиртов.
- 4. Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
- 5. Классификация спиртов 1. По числу гидроксильных групп
- 6. 2. По строению радикалов, связанных с атомом
- 7. Спирты
- 8. Гомологический ряд.СnH2n+1OH; СnH2n+2O; R-OH - общая формулаCH3-OH
- 9. НоменклатураТривиальная 2. Рациональная 3. СистематическаяC6H5- CH-CH2-CH=CH2
- 10. Изомерия изомерия положения ОН - группы, (начиная
- 11. Способы получения предельных одноатомных спиртов.Гидратацией алкенов.Из природного газа. Смесь метана с водяным паром пропускают над катализатором.
- 12. 3. Ферментативный синтез этанола.Этанол получают при брожении
- 13. 3. Восстановлением альдегидов, кетонов, карбоновых кислот. СН3
- 14. Физические свойства Следствием полярности связи О–Н и
- 15. Спирты от С1 до С12 по агрегатному
- 16. Строение молекулы спиртовCH3-CH2 → O←H H-O-HАтом кислорода
- 17. Невысокая Э.О. углерода и положительный индуктивный эффект
- 18. Общая характеристика: соединения реакционноспособны благодаря наличию двух
- 19. Реакции замещения водорода функциональной группыРеакции замещения функциональной группыРеакции элиминированияРеакции окисленияРеакции этерификацииХимические свойства спиртов
- 20. Реакции замещения Одноатомные спирты реагируют с активными
- 21. Реакции взаимодействия спиртов с щелочными и щелочноземельными
- 22. Образование сложных эфиров Спирты взаимодействуют с минеральными
- 23. Реакции замещения Замещение гидроксила ОН на галоген
- 24. 2. Взаимодействие с галогенидами фосфора.C2H5OH + PCl5→
- 25. Окисление спиртов.Горение спиртов. Спирты горят на воздухе
- 26. Иодоформная реакцияЕе проводят с помощью раствора –
- 27. Реакции окисления При действии окислителей (KMnO4, K2Cr2O7+H2SO4,
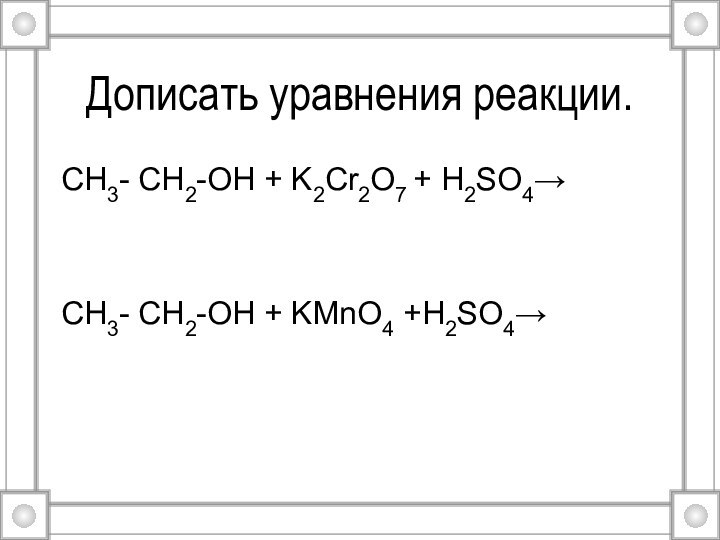
- 28. Дописать уравнения реакции.CH3- CH2-OH + K2Cr2O7 + H2SO4→CH3- CH2-OH + KMnO4 +H2SO4→
- 29. Реакции дегидратации Внутримолекулярная дегидратация спиртов с образованием
- 30. Каталитическое дегидрирование спиртов.CH3-CH2-OH→CH3-COH +H2CH3-CH-OH-CH3→CH3-CO-CH3 + H2
- 31. Применение спиртов Метанол CH3OH -производство формальдегида, муравьиной
- 32. Ядовитость спиртов.Метиловый спирт – сильный яд! Несколько
- 33. Скачать презентацию
- 34. Похожие презентации
Цели:Изучить строение, свойства, получение и применение спиртов;Уметь составлять уравнения химических реакций, характеризующих химические свойства спиртов.Уметь применять теоретические знания в осуществлении цепочек превращений и в выполнении тестовых заданий по подготовке учащихся к ЕГЭ по химии.































Слайд 2
Цели:
Изучить строение, свойства, получение и применение спиртов;
Уметь составлять
уравнения химических реакций, характеризующих химические свойства спиртов.
знания в осуществлении цепочек превращений и в выполнении тестовых заданий по подготовке учащихся к ЕГЭ по химии.
Слайд 3
План:
Классификация спиртов.
Гомологический ряд. Номенклатура. Изомерия.
Способы получения.
Строение молекулы спиртов.
Химические
свойства спиртов.
Применение спиртов.
Слайд 4 Спиртами называют производные углеводородов, в молекулах которых один
или несколько атомов водорода замещены гидроксильными группами.
Слайд 5
Классификация спиртов
1. По числу гидроксильных групп (атомность)
спирты подразделяются на одноатомные (одна группа -ОН) и многоатомные
(две и более групп -ОН).Современное название многоатомных спиртов - полиолы (диолы, триолы ит.д).
Примеры:
двухатомный спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH ; HO–СH2–(СНОН)4–CH2–OH сорбит
Слайд 6
2. По строению радикалов, связанных с атомом кислорода,
различают
спирты:
предельные, или алканолы (например, СH3CH2–OH)
непредельные, или
алкенолы (CH2=CH–CH2–OH) аллиловый спирт.ароматические (C6H5CH2–OH). Бензиловый спирт.
3. Низшие и высшие спирты (от количества атомов углерода входящих в состав спирта) до С10 – низшие, свыше С10 – высшие. (С12H25–OH – лауриловый,
С16H33–OH – цетиловый спирт.
Слайд 7 Спирты могут
быть первичными, вторичными или третичными в зависимости от того,
при каком атоме углерода находится гидроксильная группа.
Слайд 8
Гомологический ряд.
СnH2n+1OH; СnH2n+2O; R-OH - общая формула
CH3-OH –
метанол, СH4O
СH3- CH2- OH – этанол, С2H6O
СH3- CH2-СH2-
OH – пропанол, С3H8OСH3- CH2-СH2- СH2- OH- бутанол, С4H10O
СH3- CH2-СH2- СH2- СH2- OH- пентанол,
С5H12O (амиловый спирт).
СH3- CH2-СH2- СH2- СH2- СH2- OH- гексанол.
С6H14O
Слайд 9
Номенклатура
Тривиальная 2. Рациональная 3. Систематическая
C6H5- CH-CH2-CH=CH2
│
1-фенилбутен-3-ол-1OH аллилфенилкарбинол
CH3-CH(CH3)-CH2-OH- изопропилкарбинол
CH3- CH-CH2-CH3
│ метилэтилкарбинол.
OH
Слайд 10
Изомерия
изомерия положения ОН - группы, (начиная с
С3) ;
углеродного скелета, (начиная с С4 );
межклассовая
изомерия с простыми эфирами.Например, одну и ту же молекулярную формулу
С2H6O имеют:
СН3CH2–OH и CH3–O–CH3
этиловый спирт диметиловый эфир
CH3- CH2-CH2-CH2-CH2-OH CH3- CH-CH2- CH2-CH3
│
OH
CH3- CH2-CH-CH2-OH
│
CH3
Слайд 11
Способы получения предельных одноатомных спиртов.
Гидратацией алкенов.
Из природного газа.
Смесь
метана с водяным паром пропускают над катализатором.
Слайд 12
3. Ферментативный синтез этанола.
Этанол получают при брожении сахаров,
вызываемом ферментами:
Лабораторные
способы:1. Гидролиз галогеналканов – под действием водных растворов щелочей.
СН3 – СН2 – Cl +NaOH→CH3-CH2-OH+NaCl
2. Из сложных эфиров – при кипячении с разбавленной кислотой или щелочью образуется карбоновая кислота или её соль и спирт.
СH3-COOC2H5 + KOH → CH3 – COOK + C2H5OH
Слайд 13
3. Восстановлением альдегидов, кетонов, карбоновых кислот.
СН3 –
СО – СН3 + Н2 → СН3 – СНОН
– СН34.Взаимодействие альдегидов и кетонов с реактивом Гриньяра.
Н – СОН + R – MgCl → R – CH2 – OMgCl + H2O → R – CH2OH + MgOHCl
Слайд 14
Физические свойства
Следствием полярности связи О–Н и наличия
неподеленных пар электронов на атоме кислорода является способность гидроксисоединений
к образованию водородных связейR R R
/ / /
H − O:δ- ⋅ ⋅ ⋅ Hδ+ − O:δ- ⋅ ⋅ ⋅ Hδ+ −O:
Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения (т.кип. метанола +64,5 °С).
При испарении жидкости водородные связи между молекулами разрываются. Низшие спирты хорошо растворимы в воде. Поэтому молекулы спиртов образуют водородные связи с молекулами воды.
Слайд 15
Спирты от С1 до С12 по агрегатному состоянию
– жидкости, высшие спирты – твердые вещества.
В отличие от
углеводородов спиртов нет в газообразном состоянии. Это связано с образованием водородных связей.Спирты – растворители. С увеличением относительной молекулярной массы растворимость спиртов уменьшается. Твердые спирты в воде не растворимы.
Температура кипения спиртов выше чем у углеводородов.
Слайд 16
Строение молекулы спиртов
CH3-CH2 → O←H
H-O-H
Атом кислорода наиболее
электроотрицателен по сравнению с углеродом и водородом, поэтому связи
C-O и O-H ковалентные полярные. Более полярна связь в гидроксильной группе. При химических реакциях она может гетеролитический разрываться с отщеплением катиона водорода.Легкость разрыва связи кислород-водород в гидроксидах зависит от природы и степени окисления атома, связанного с группой OH. Чем выше элекроотрицательность и степень окисления этого атома, тем сильнее кислотные свойства.
Слайд 17
Невысокая Э.О. углерода и положительный индуктивный эффект этильной
группы приводят к тому , что спирты проявляют более
слабые кислотные свойства даже по сравнению с водой.Вывод: спирты проявляют очень слабые кислотные свойства, способны вступать в реакции нуклеофильного замещения, элиминирования, окисления.
Слайд 18
Общая характеристика: соединения реакционноспособны благодаря наличию двух ковалентных
связей
O-H; C-O. Можно выделить следующие типы реакции: с
разрывом связи O-H и C-O.
Слайд 19
Реакции замещения водорода функциональной группы
Реакции замещения функциональной группы
Реакции
элиминирования
Реакции окисления
Реакции этерификации
Химические свойства спиртов
Слайд 20
Реакции замещения
Одноатомные спирты реагируют с активными металлами
(Na, K, Mg, Al и др), образуя соли -
алкоголяты (алкоксиды):2R–OH + 2K → 2RO– K + H2
2C2H5OH + 2Na → 2C2H5O– Na + H2
этилат натрия
Слайд 21
Реакции взаимодействия спиртов с щелочными и щелочноземельными металлами
протекает медленно чем с водой т.к. кислотные свойства выражены
очень слабо. С увеличением углеводородного радикала, скорость этой реакции замедляется. В присутствии воды алкаголяты подвергаются гидролизу.C2H5ONa + H2O→ C2H5OH + NaOH Это доказывает, что спирты более слабые кислоты, чем вода.
Слайд 22
Образование сложных эфиров
Спирты взаимодействуют с минеральными и
органическими кислотами, образуя сложные эфиры: (реакция этерификации).
(H+)
R–O–H + HO–C–R' ⎯⎯→ R–O–C–R' + H2Oспирт | | | |
O O
кислота сложный эфир
Примеры:
CH3–O–H + HO–СO–CH3 ⎯→ CH3–OСOCH3 + H2O
метанол уксусная кислота метилацетат
C2H5–O–H + HO–NO2 ⎯→ C2H5–O–NO2 + H2O
этанол этилнитрат
Слайд 23
Реакции замещения
Замещение гидроксила ОН на галоген происходит
в реакции спиртов с галогеноводородами в присутствии катализатора –
сильной минеральной кислоты (например, конц. H2SO4).(H+)
C2H5OH + HBr ⎯⎯→ C2H5Br + H2O
этилбромид
Механизм реакции – нуклеофильное замещение (SN).
Нуклеофил – бромид-анион Br– – замещает группу ОН–.
Реакционная способность ROH возрастает в ряду:
CH3 OH < первичные < вторичные < третичные.
Слайд 24
2. Взаимодействие с галогенидами фосфора.
C2H5OH + PCl5→ C2H5Cl
+ POCl3 + HCl
хлорокись фосфора3C2H5OH + PBr3→3C2H5Br +H3PO3
C2H5OH + SOCl2 → C2H5Cl + SO2 + HCl
хлористый тионил
Слайд 25
Окисление спиртов.
Горение спиртов. Спирты горят на воздухе бледно
– голубым пламенем. Спирты с большей молекулярной массой горят
светящимся пламенем и после сгорания остается черный налет.C2H5OH + 3O2→2CO2 +3H2O + Q
Качественная реакция на спирты.
СH3-CH2-OH+CuO→CH3-COH + Cu +H2O
CH3-CHOH-CH3 +[O] →CH3-CO-CH3 +H2O
Слайд 26
Иодоформная реакция
Ее проводят с помощью раствора – реактива
Люголя, который получают растворением иода в растворе иодида калия.
На
первой стадии происходит окисление этилового спирта до уксусного альдегида.CH3-CH2-OH + I2→CH3-COH +2HI
2 cтадия. Замещение атомов водорода метильной группы на атомы иода:
CH3-COH + 3I2→I3C-COH +3HI
3.В щелочной среде трииодацетальдегид разлагается на иодоформ и формиат натрия:
I3C-COH + NaOH→CHI3 + HCOONa
Признак наличия этанола – помутнение смеси и характерный запах иодоформа CHI3.
Слайд 27
Реакции окисления
При действии окислителей (KMnO4, K2Cr2O7+H2SO4, O2+катализатор)
группа
>СH–О–Н превращается в карбонильную группу >С=О,
а гидроксисоединение – в
карбонильное соединение.Первичные спирты при окислении образуют альдегиды, которые затем
легко окисляются до карбоновых кислот:
[O] [O]
R–СН2–OH ⎯⎯→ R–СН=O ⎯⎯→ R–СOOH
-H2O альдегид карбоновая кислота
Например, окисление этилового спирта K2Cr2O7 / H2SO4 :
3C2H5OH + 2K2Cr2O7 + 8H2SO4 → 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
При окислении вторичных спиртов
образуются кетоны:
[O]
R−CH−R' ⎯⎯→ R−C−R'
| -H2O ||
OH O
Слайд 29
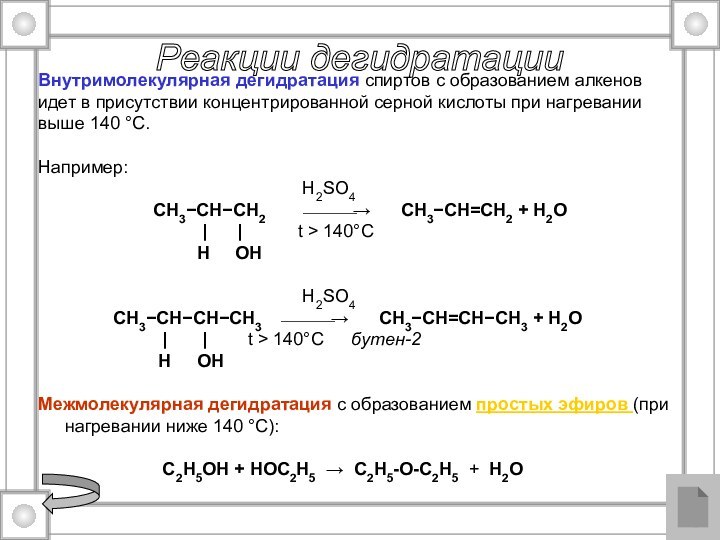
Реакции дегидратации
Внутримолекулярная дегидратация спиртов с образованием алкенов
идет в присутствии концентрированной серной кислоты при нагревании
выше 140
°С. Например:
H2SO4
CH3−CH−CH2 ⎯⎯⎯→ CH3−CH=CH2 + H2O
| | t > 140°C
H OH
H2SO4
CH3−CH−CH−CH3 ⎯⎯⎯→ CH3−CH=CH−CH3 + H2O
| | t > 140°C бутен-2
H OH
Межмолекулярная дегидратация с образованием простых эфиров (при нагревании ниже 140 °С):
C2H5OH + HOC2H5 → C2H5-O-C2H5 + H2O
Слайд 31
Применение спиртов
Метанол CH3OH
-производство формальдегида, муравьиной кислоты;
- растворитель.
Этанол С2Н5ОН (этиловый спирт)
- производство ацетальдегида, уксусной
кислоты, бутадиена,простых и сложных эфиров;
- растворитель для красителей, лекарственных и парфюмерных средств;
- производство ликеро-водочных изделий;
- дезинфицирующее средство в медицине;
- горючее для двигателей, добавка к моторным топливам.
Слайд 32
Ядовитость спиртов.
Метиловый спирт – сильный яд! Несколько граммов
его, попав в организм человека, вызывает слепоту, а большее
количество приводит к смерти. Поэтому метиловый спирт, используемый для технических нужд, объязательно должен носить название метанол – яд.Этиловый спирт(этанол) – бесцветная жидкость с характерным запахом.
Спирт, содержащий 4-5% воды, называют ректификатом, а только доли процента – абсолютным спиртом. Этиловый спирт, получаемый брожением сахаристых веществ (в присутствии ферментов, например, дрожжей) называют пищевым или винным спиртом. Спирт, получаемый из глюкозы, которую получают гидролизом целлюлозы, называют гидролизным.
Этиловый спирт – сильный наркотик.
Спирт, применяемый для технических целей, специально загрязняют дурнопахнущими веществами. Такой спирт называют денатуратом.





























