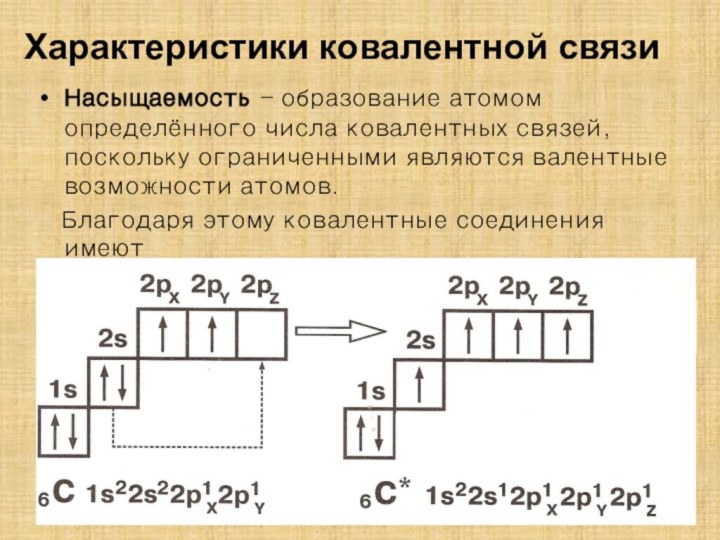
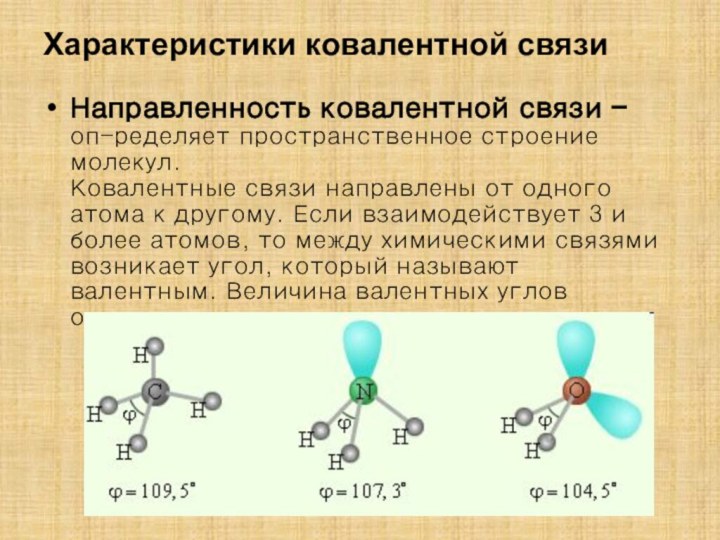
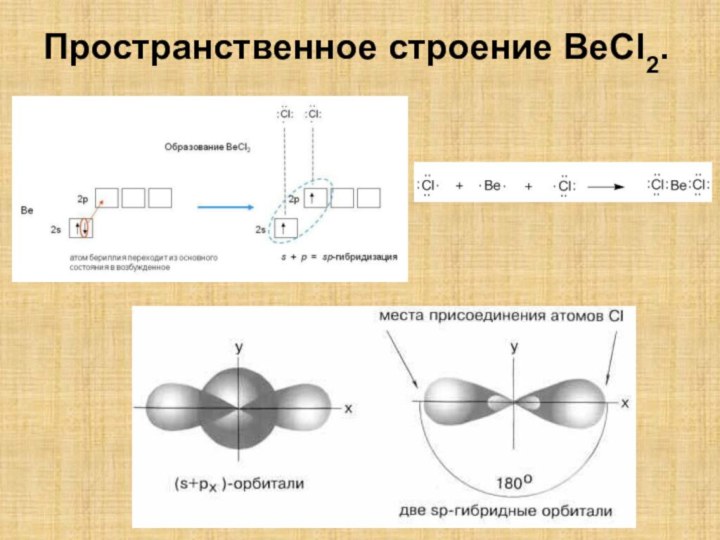
гибридизации атомных орбиталей в органических соединениях;
научить применять данные
знания для объяснения гибридизации в неорганических соединениях;Закрепить знания зависимости пространственного строения молекул частицы от типа гибридизации.