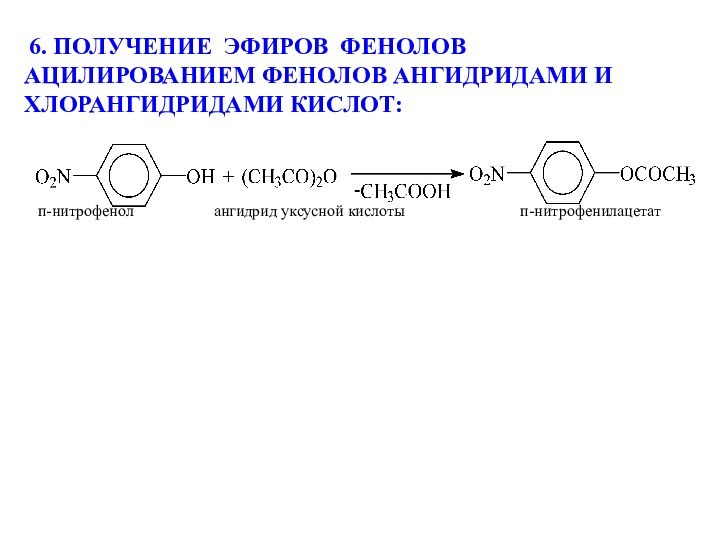
моногалогенпроизводных водными растворами щелочей
CH3–Br + NaOH(водн.) CH3–OH +
NaBr бромметан метанол
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


































![Основные способы получения кислородсодержащих соединений 5. ЩЕЛОЧНОЙ ГИДРОЛИЗ ТРИХЛОРИДОВ:R-CCl3 + 3NaOH [R-C(OH)3] + 3NaCl](/img/tmb/14/1343817/3161369d4efd88c3a5b4c90bf89edb93-720x.jpg)



















CH2=CH2 + H2O CH3-CH2-OH
CH3–CH=CH2 + H2O CH3-CH-CH3
Ι
Ι
CH3–C=CH2 + H2O → CH3 –C–СH3
Ι Ι
СН3 СН3
t⁰, H
t⁰, H
t⁰, H
этилен этанол
2 –метилпропилен 2-метилпропанол-2
пропилен пропанол-2
ОН
ОН
t,kat
t,kat
H2SO4,t
фермент
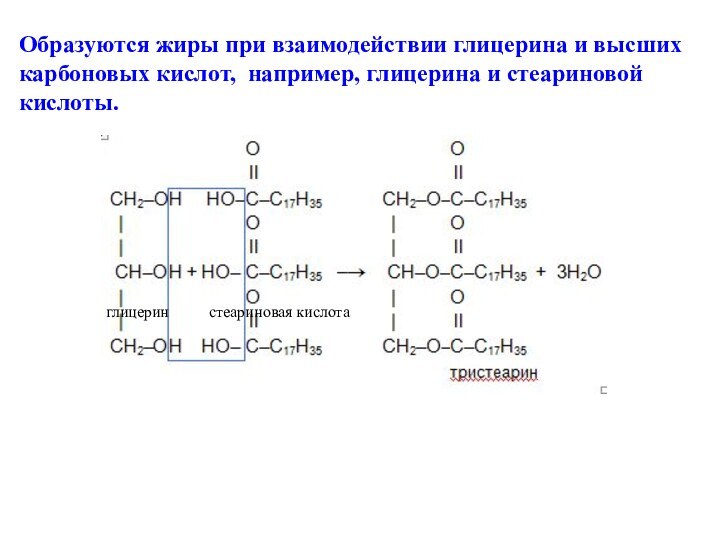
1,2,3 – трихлорпропан пропантриол -1,2,3
вод.р-р
t,kat
4.ОКИСЛЕНИЕ АЛКЕНОВ ХОЛОДНЫМ ВОДНЫМ РАСТВОРОМ KMnO4 (окисляются до многоатомных спиртов (полиолов) )
Раствор фиолетовый обесцвечивается и выпадает бурый осадок MnO2
3CH2=CH2 + 2KMnO4 + 4H2O 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
этилен этиленгликоль
280⁰С, p, Ag
H₂O, H⁺, 200⁰С
этиленоксид
450⁰С
щелочная среда
щелочная среда
AlCl3
t,p
фенолят натрия фенол
бензол
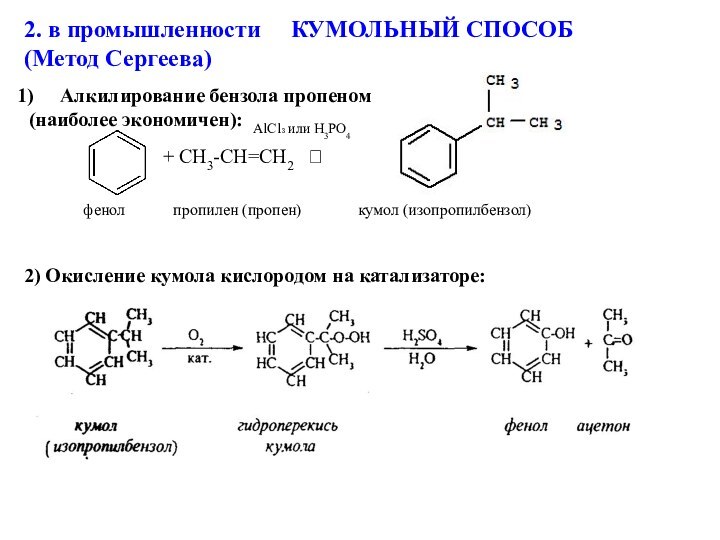
Алкилирование бензола пропеном
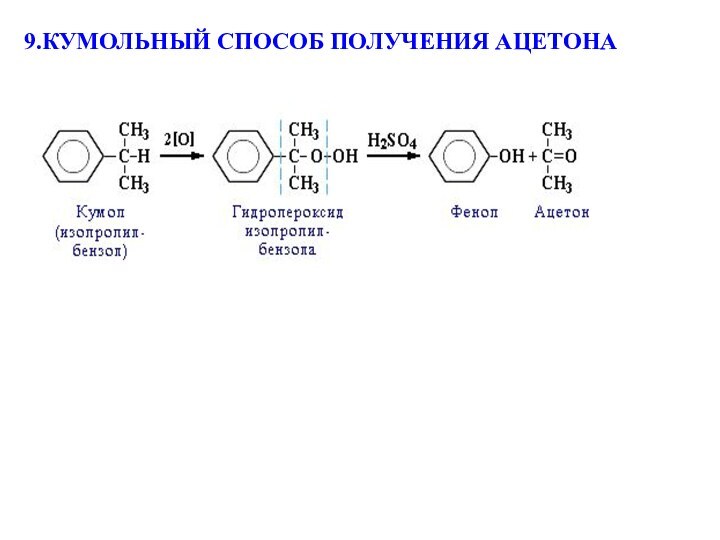
(наиболее экономичен):
+ CH3-CH=CH2
2) Окисление кумола кислородом на катализаторе:
AlCl₃ или H3PO4
фенол пропилен (пропен) кумол (изопропилбензол)
4. ВЫДЕЛЕНИЕ ИЗ ПРОДУКТОВ КОКСОВАНИЯ УГЛЯ.
t
t
t, кат.
t, кат.
в) ОКИСЛЕНИЕ ЭТИЛЕНА → ЭТАНАЛЬ
(катализаторы - хлориды Pd и Cu)
метанол метаналь
метаналь
этилен этаналь
СН3–CCl2- CH3 + 2 KOH (водн) CH3- CO - CH3 +2KCl+H2O
1,1-дихлорпропан пропаналь
2,2-дихлорпропан пропанон
ацетилен
пропин
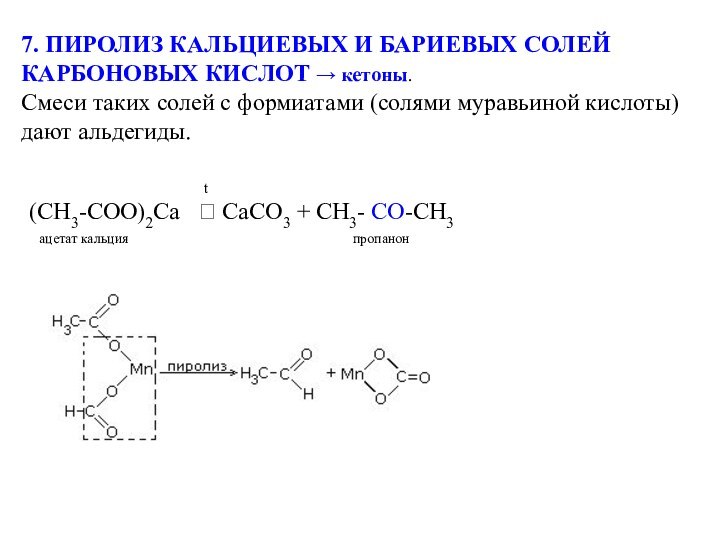
(СН3-СОО)2Са CaCO3 + CH3- CО-CH3
ацетат кальция пропанон
t
метан муравьиная кислота
церезин стеариновая кислота
бутан уксусная кислота
t,kat
t,kat
KMnO4,H+
C6H5-CnH2n+1 + 3n[O] → C6H5-COOH + (n-1)CO2 + nH2O
формиат натрия муравьиная кислота
t,p
t,p
t,p
II. В ЛАБОРАТОРИИ
1. ИЗ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ:
СН₃-COONa + HCl → СН₃ -COOH + NaCl
ацетат натрия уксусная кислота
OH-
R-COOR1 + H2O ↔ RCOOH + R1-OH
H+
OH-
СН₃-COO-С₂Н₅ + H2O ↔ СН₃-COOH + С₂Н₅-OH
этилацетат H+ уксусная кислота этиловый спирт
ангидрид уксусной кислоты уксусная кислота
ангидрид кислоты кислота
R- C = O + NaOH → R-COOH + NaCl
Ι
Cl
хлорангидрид уксусная
уксусной кислоты кислота
хлорангидрид кислота
кислоты
СН₃ -CCl3 + 3NaOH [СН₃ -C(OH)3] + 3NaCl
неустойчивое вещество
[СН₃ -C(OH)3] СН₃ COOH + H2O
1,2,3-трихлорэтан
уксусная кислота
уксусная кислота
трихлорид
H+
H+
метилцианид уксусная кислота
цианид кислота
бромэтан цианид натрия метилцианид
нитрил уксусной кислоты
метилцианид
ацетат аммония
t
H+
ацетат аммония уксусная кислота
R-MgBr + CO2 R-COO-MgBr
R-COO-MgBr R-COOH +Mg(OH)Br
H2O
СН3-MgBr + CO2 СН3-COO-MgBr
СН3-COO-MgBr СН3-COOH +Mg(OH)Br
магнийметилбромид
уксусная кислота гидроксобромид магния
H2O
NH3
t
200 °С, Р
H2SO4
4. Бензойную кислоту можно получить из бензальдегида с помощью реакции Канниццаро.
Бензальдегид обрабатывают 40—60%-ным раствором гидроксида натрия при комнатной температуре. Одновременное окисление и восстановление приводит к образованию бензойной кислоты и фенилметанола (бензилового спирта):
H₂SO₄
уксусная кислота этиловый спирт этилацетат
CH3COOCl + CH3OH → CН3COOCH3 + HCl
ацетилхлорид метанол метилацетат
t
t
t
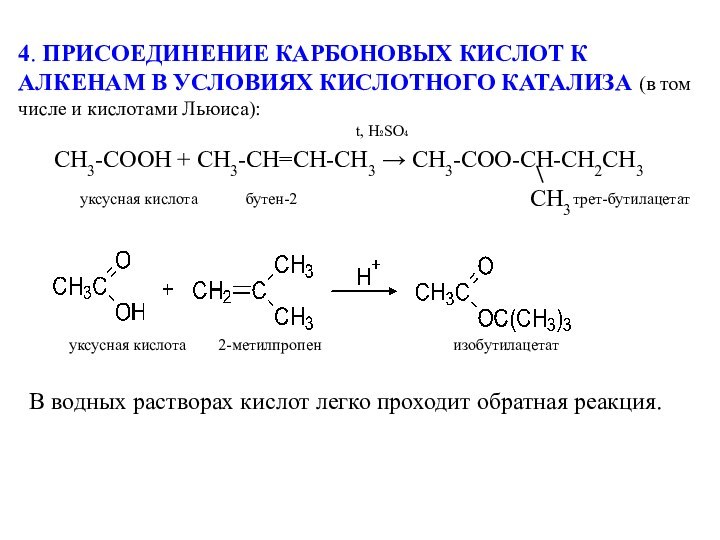
В водных растворах кислот легко проходит обратная реакция.
CH3
\
уксусная кислота 2-метилпропен изобутилацетат
уксусная кислота бутен-2 трет-бутилацетат
t, H₂SO₄
Са(ОН)₂