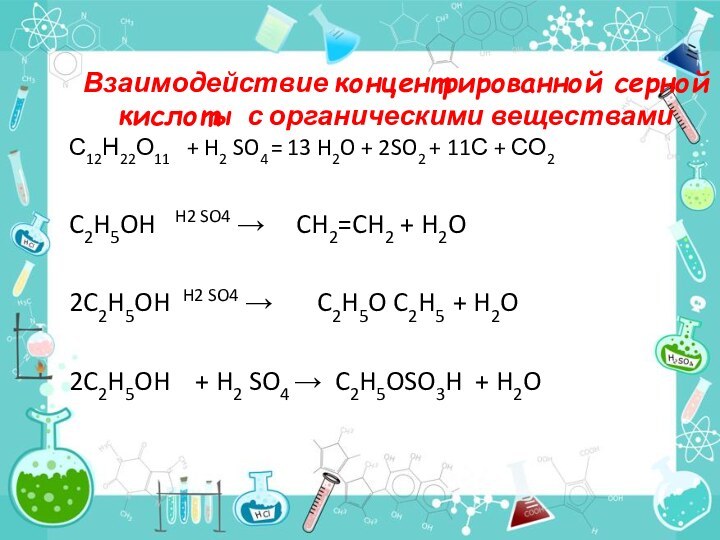
вещество, столь часто применяемое в технике, как серная кислота.
Там, где техническая деятельность развита, там потребляется и много серной кислоты.Д. И. Менделеев
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть