- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Ковалентная полярная связь
Содержание
- 2. Мы условно разделили элементы на металлы
- 3. А какой тип связи мы можем ожидать при образовании соединений между атомами разных неметаллов?
- 4. Очевидно, опять ковалентную связь – засчет
- 5. Атомы разных элементов по-разному относятся к
- 6. Ковалентная полярная химическая связьУрок на тему:
- 7. Цель урока: 1. Продолжить формирование понятия о
- 8. Электроотрицательность Способность атомов химических элементов оттягивать к себе общие электронные пары, называется электроотрицательнос-тью (ЭО)
- 9. Ряд электроотрицательности химических элементов H As I
- 10. Запишите в тетрадь (на странице 64,
- 11. Ряд электроотрицательности элементов поможет вам определить,
- 12. Разумеется, атомы менее электроотрицательного элемента будут
- 13. Между атомами одного и того же
- 14. Теперь давайте с вами запишем алгоритм образования молекулы SCl2
- 15. 1. Определить число внешних электронов у
- 16. 2. Записать символ элемента – неметалла,
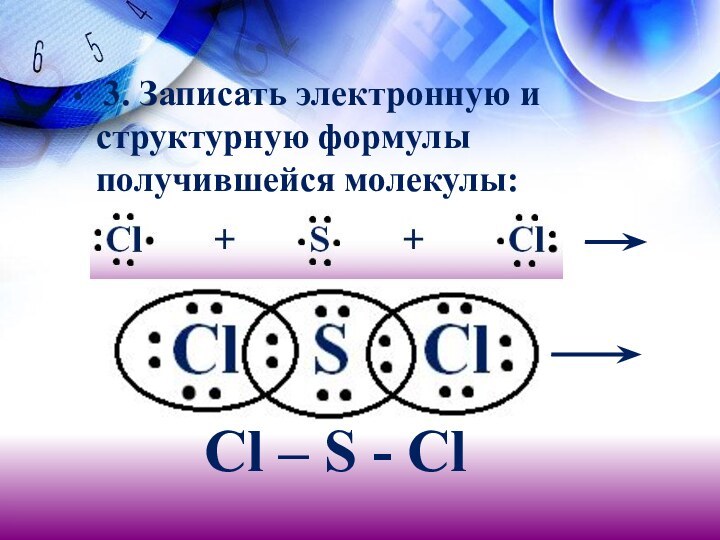
- 17. 3. Записать электронную и структурную формулы
- 18. 4. Определить по ряду электроотрицательности, к
- 19. Закрепление Упражнение №2 на странице 66
- 20. Скачать презентацию
- 21. Похожие презентации
Мы условно разделили элементы на металлы и неметаллы. Рассмотрели, как образуются связи между атомами металлов и неметаллов (как называется такой вид связи?), между атомами одного и того же элемента неметалла (как называется такой вид связи?)



















Слайд 3 А какой тип связи мы можем ожидать
при образовании соединений между атомами разных неметаллов?
Слайд 4 Очевидно, опять ковалентную связь – засчет образования
общих электронных пар.
Но ведь элементы – то разные!!!
Наверное, следует ожидать, что такая ковалентная связь будет отличаться от рассмотренной ранее ковалентной связи.Слайд 5 Атомы разных элементов по-разному относятся к общим
электронным парам: те неметаллы, что сильнее, будут сильнее оттягивать
к себе общие электронные пары, совсем как у Крылова: «У сильного всегда бессильный виноват…»
Слайд 7
Цель урока:
1. Продолжить формирование понятия о ковалентной
химической связи.
2. Познакомить учащихся с полярной ковалентной химической
связью и электроотрицательностью (ЭО) как мерой неметалличности элементов.3. Продолжить формирование умения записывать схемы образования молекул бинарных соединений элементов – неметаллов.
Слайд 8
Электроотрицательность
Способность атомов химических элементов оттягивать к себе
общие электронные пары, называется электроотрицательнос-тью (ЭО)
Слайд 9
Ряд электроотрицательности химических элементов
H As I Si
P Se C S Br Cl N O F
Усиление электроотрицательностиСлайд 10 Запишите в тетрадь (на странице 64, §11)
как изменяется ЭО в периоде и подгруппе (смтр. запись
курсивом со слов: в каждом периоде…)Слайд 11 Ряд электроотрицательности элементов поможет вам определить, в
сторону атомов какого химического элемента будут смещены общие электронные
пары, а, следовательно, на каком из атомов будет избыточный отрицательный заряд (он будет обозначаться буквой «δ» – греч. дельта), а, значит, где будет отрицательный полюс молекулы.Слайд 12 Разумеется, атомы менее электроотрицательного элемента будут иметь
избыточный положительный заряд, т.е. будут представлять собой как бы
положительный полюс молекулы с зарядом δ+.Вот вам и стало понятно название этой разновидности ковалентной связи – полярная.
Слайд 13 Между атомами одного и того же элемента
неметалла, т.е. с одинаковой электроотрицательностью, общие электронные пары не
смещены ни к одному из атомов, поэтому они не имеют заряда – полюса и это неполярная ковалентная связь.Слайд 15 1. Определить число внешних электронов у атомов
неметаллов и по формуле 8 – N число неспаренных
электронов. Записать электронные формулы атомов:Слайд 16 2. Записать символ элемента – неметалла, который
представлен одним атомом (S), в центр и знаком «плюс»
– два атома другого элемента (Сl):Слайд 18 4. Определить по ряду электроотрицательности, к атомам
какого из элементов смещены общие электронные пары, и заменить
черточки маленькими стрелками, обозначить полюса:Clδ- Sδ+ Clδ-