- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Классификация химических реакций
Содержание
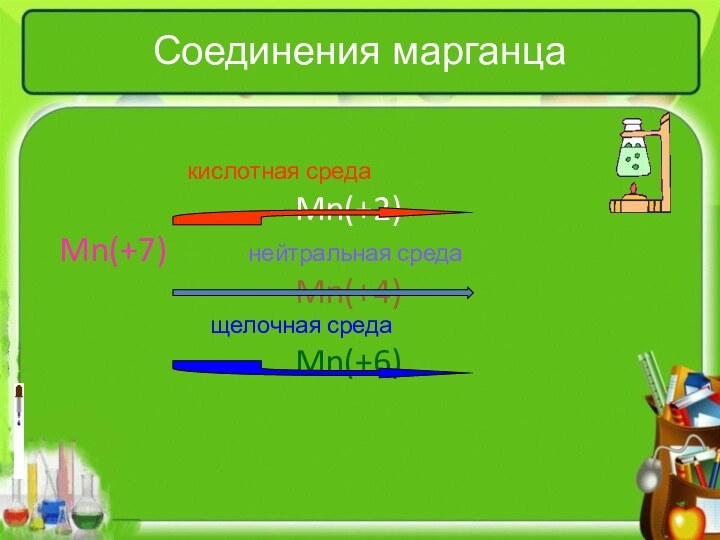
- 3. Соединения марганца кислотная среда Mn(+2) Mn(+7)
- 4. Соединения марганца окислитель Mn(+2)MnO2 восстановитель Mn(+6,+7)
- 5. Соединения хрома
- 10. Внимание! Упражнение!KMnO4+KNO2+H2SO4=KMnO4+KNO2+H2O=KMnO4+KNO2+КОН=MnO2+KNO2+H2SO4=MnO2+KNO3+KOH=Cr2O3+KClO3+KOH=KCrO2+Br2+KOH=K2CrO4 + H2O + H2S=Cr2(SO4)3+KMnO4+H2O=K2Cr2O7+HI+H2SO4=
- 11. Что вы поняли на уроке
- 12. Спасибо за работу
- 13. Скачать презентацию
- 14. Похожие презентации
Цель урока Рассмотреть особенности строения атомов хрома и марганца, на основании строения электронных оболочек предсказать возможные степени окисления этих элементов в соединениях. Отработать умения составлять уравнения окислительно-восстановительных реакций методом











Слайд 2
Цель урока
основании строения электронных оболочек предсказать возможные степени окисления этих элементов в соединениях. Отработать умения составлять уравнения окислительно-восстановительных реакций методом электронного баланса. Выяснить влияние среды на окислительные свойства перманганат-иона. Воспитывать навыки самооценки знаний, совместной работы в группах, умения логически мыслить, наблюдательность.
Слайд 3
Соединения марганца
кислотная среда
Mn(+2)
Mn(+7)
нейтральная среда
Mn(+4)
щелочная средаMn(+6)