связи в комплексных соединениях.
2. Изучить реакции
комплексных соединений и факторы, влияющие на устойчивость.3. Рассмотреть применение комплексных соединений в военно-химической практике.
Основная литература:
Н.С. Ахметов. Общая и неорганическая химия. М.: Высшая школа . 2003. С. 206-208.
2. Общая и неорганическая химия. Учебное пособие. СВИРХБЗ.
Ч 3. 2003. C. 83-96.
Дополнительная литература:
Учебная программа по дисциплине «Общая и неорганическая химия». 2001. 19 с.
2. М.И. Сафарова. Общая и неорганическая химия в схемах и таблицах. Ч.1. Теоретические основы неорганической химии. Учебное пособие. Саратов. СВИРХБЗ. 2006. С. 80.





![Комплексные соединения.Свойства комплексных соединений. [Co(H2O)6]2+ розовый[Co(CH3COO)2] ярко-розовый [Co(NO2)6]4-](/img/tmb/12/1167740/8fe7a3135cf2c8223e541ab8aa7edf29-720x.jpg)

![Комплексные соединения.Свойства комплексных соединений. K3[Fe(CN)6] 3K+ + [Fe(CN)6]3-](/img/tmb/12/1167740/85c7588a9ce689253e59f8fc75702cff-720x.jpg)
![Комплексные соединения.Свойства комплексных соединений. [Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)2]+](/img/tmb/12/1167740/30232a800485a821ef59816634521131-720x.jpg)
![Комплексные соединения.Свойства комплексных соединений. Реакции комплексных соединенийпо внешней сфере2K3[Fe(CN)6] + 3FeSO4 =](/img/tmb/12/1167740/2e599584b1414e38681f410aee2aa93d-720x.jpg)


![Комплексные соединения.Свойства комплексных соединений. 3. Разбавление K[AgCl2] = KCl + AgCl↓ 5. Окислительно-восстановительные](/img/tmb/12/1167740/b4826b3f370d7e032fd585d7631caa52-720x.jpg)

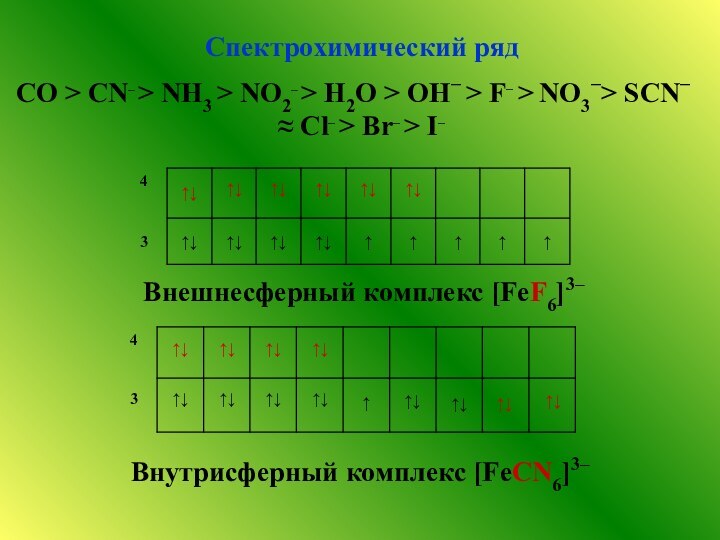
![Комплексные соединения.Свойства комплексных соединений. При одинаковом координационном числе Сравнение прочности комплексовпо общим константам нестойкости [Fe(SCN)6]3- +](/img/tmb/12/1167740/6d7cab2efa60b07f8d07ec56e1c3d51d-720x.jpg)