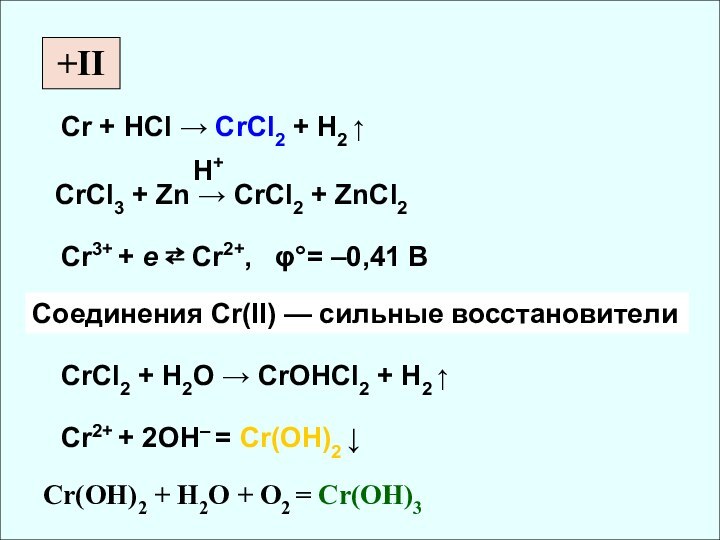
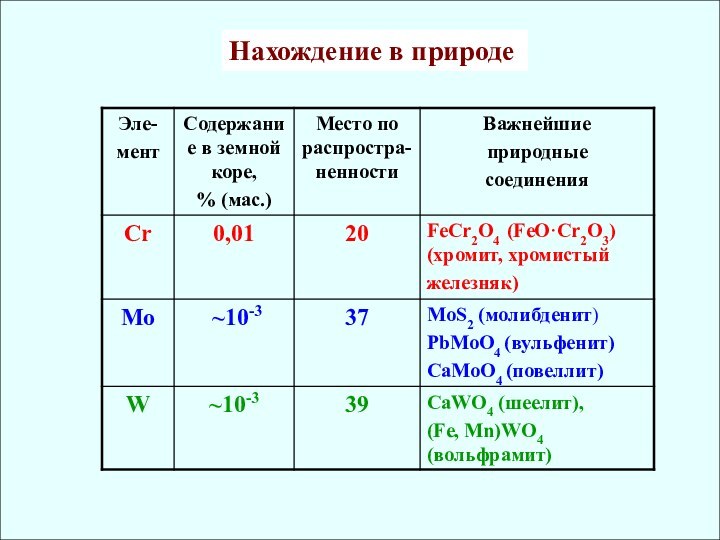
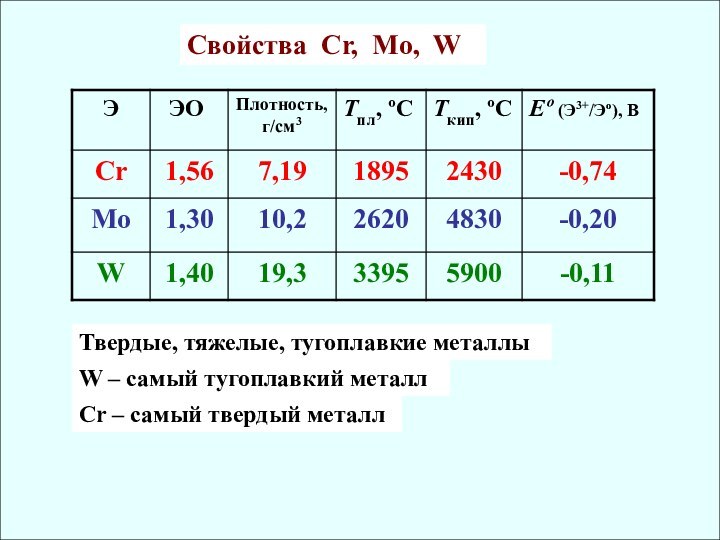
rат, нм
СО Cr [Ar] 3d54s1 0,126 II, III, VI
Mo [Kr] 4d55s1 0,136 (IV, V), VI
W [Xe] 4f145d46s2 0,137 (IV, V), VI
r Mo ≈ r W как следствие лантаноидного сжатия
Склонность к проявлению высшей СО растёт
Убывание кислотных свойств (H2CrO4 и H2MoO4)
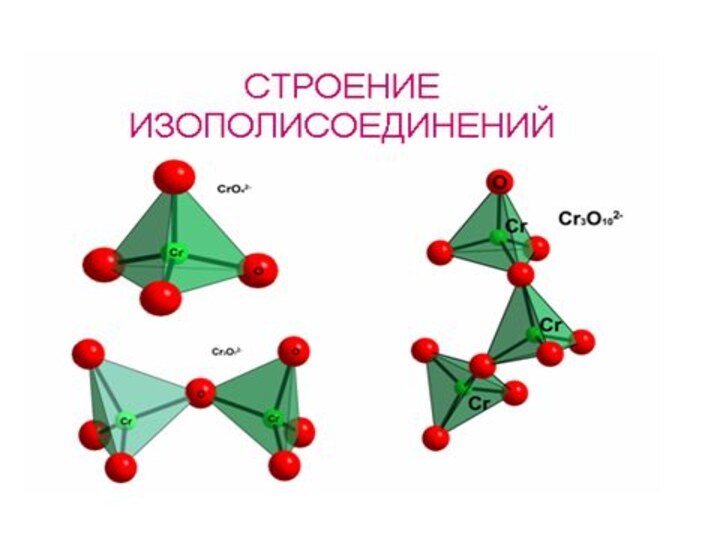
Активные комплексообразователи (изополи- и
гетерополисоединения)




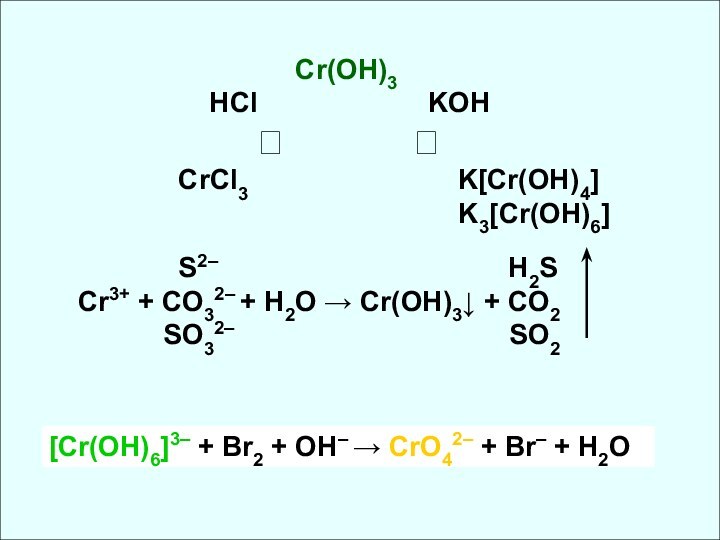
![Химия элементов VIB подгруппы Cr, Mo, W Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит натрияCr2O3](/img/tmb/14/1377859/80917d84ab6cd023c7062a3107c4dc88-720x.jpg)



![Химия элементов VIB подгруппы Cr, Mo, W Вольфрам. Изополисоединения. [H2W12O42]10-- паравольфрамат Б-ион; [H2W12O40]6-- метавольфрамат-ион[W7O24]6-- паравольфрамат А-ионNa2MoO4 — 3MoO3 •](/img/tmb/14/1377859/584887babe6872297e463b69c9ba473d-720x.jpg)


![Химия элементов VIB подгруппы Cr, Mo, W [Cr(H2O)6]3+](/img/tmb/14/1377859/677b4ec80e725e7d926887edada14cad-720x.jpg)
![Химия элементов VIB подгруппы Cr, Mo, W CrIIICrVICr3+[Cr(OH)6]3-Cr2O72-CrO42-H+H+OH-OH-Схема переходов CrIII в CrVI в различных средах+ восстановитель+ окислитель](/img/tmb/14/1377859/57fb156b72839e614aa85a37fe362f49-720x.jpg)