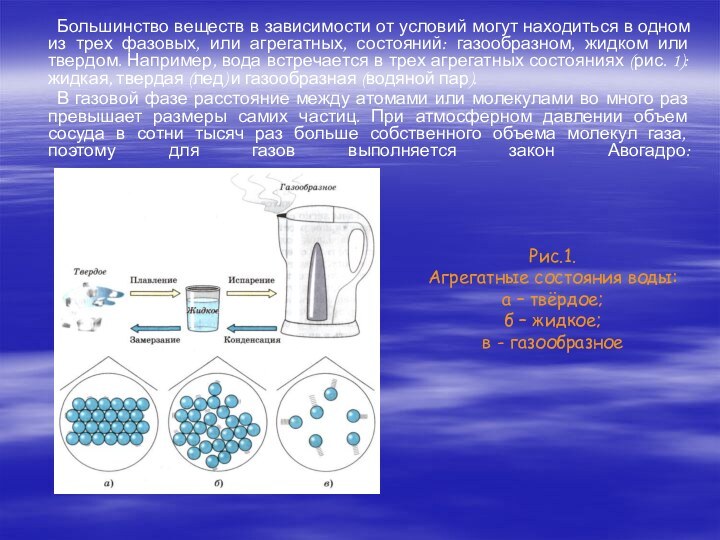
атмосферу, изменяя ее свойства. Так, в результате увеличивающегося сжигания
топлива и уменьшения площадей, занятых растительностью, фотосинтетическое восстановление кислорода из углекислого газа в настоящее время уменьшилось на 30% за последние 10 тыс. лет. Ежегодная убыль кислорода составляет 31,62 млрд т. Если учесть, что в атмосфере содержится 1200 трлн. т кислорода, то его количество в атмосфере за год уменьшается на 0,0025%. Казалось бы, это немного, но, очевидно, в конце концов может встать вопрос о введении ограничений на потребление кислорода.
Накопление в атмосфере углекислого газа и других веществ в атмосфере — причина парникового эффекта.
Рассмотрим это явление. Максимальная концентрация озона в атмосфере наблюдается на высоте 20—25 км. Известно, что озон поглощает ультрафиолетовые лучи. При этом он сильно разогревается и препятствует потере тепла нижними слоями атмосферы. Помимо этого, озон, как и углекислый газ, поглощает инфракрасное излучение Земли. Следовательно, озон не только спасает все живое на Земле от ультрафиолетовых лучей, но вместе с углекислым газом играет важную роль в тепловом балансе атмосферы Земли. Парниковый эффект приводит к глобальному потеплению климата. Чтобы понять, как оно возникает, вспомните, как нагревается автомобиль изнутри, когда он стоит с закрытыми окнами на солнце. Солнечный свет проникает через стекла и поглощается сиденьями и другими предметами салона. При этом световая энергия превращается в тепловую, которую предметы отражают в виде инфракрасного излучения. В отличие от света, оно почти не проникает сквозь стекла наружу, т. е. остается внутри автомобиля. За счет этого повышается температура. То же самое происходит и в парнике, отчего и произошел термин «парниковый эффект».